(12分)单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
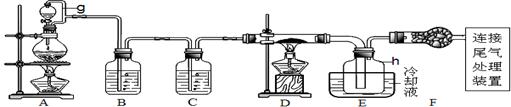
相关信息:①四氯化硅遇水极易水解;②SiCl4沸点为57.7℃,熔点为-70.0℃。请回答:
(1)写出装置A中发生反应的离子方程式 。
(2)装置C中的试剂是 ;装置F的作用是 ;
装置E中的h瓶需要冷却的理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①反应的离子方程式: 。
②滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
③滴定前检验Fe3+是否被完全还原的实验操作是 。
aF是一种重要的氟盐,主要用作农作物杀虫剂、木材防腐剂等。某课题组设计了以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵的实验,其工艺流程如下: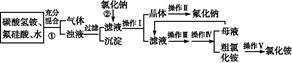
已知:20 ℃时氯化铵的溶解度为37.2 g,氟化钠的溶解度为4 g,Na2SiF6微溶于水。
(1)操作Ⅱ是洗涤、干燥,其目的是 ,
操作Ⅲ和操作Ⅳ的名称依次是 (填写序号)。
a.过滤b.加热蒸发 c.冷却结晶 d.洗涤
(2)上述流程中①的化学反应方程式:
H2SiF6+ NH4HCO3 NH4F+ H2SiO3↓+ CO2↑+
NH4F+ H2SiO3↓+ CO2↑+
(3)流程①中NH4HCO3必须过量,其原因是 。
(4)若不考虑氟化钠的溶解,7.2 g氟硅酸理论上最多能生产 g氟化钠。
某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用470 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从图中选择称量NaOH固体所需要的仪器是(填字母): 。
| 名称 |
托盘天平 (带砝码) |
小烧杯 |
坩埚钳 |
玻璃棒 |
药匙 |
量筒 |
| 仪器 |
 |
 |
 |
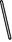 |
 |
 |
| 序号 |
a |
b |
c |
d |
e |
f |
Ⅱ.测定中和热
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、盐酸、NaOH溶液,尚缺少的实验玻璃用品是 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
| 实验 次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
|||
| H2SO4 |
NaOH |
平均值 |
||||
| 1 |
26.2 |
26.0 |
26.1 |
30.1 |
||
| 2 |
27.0 |
27.4 |
27.2 |
33.3 |
||
| 3 |
25.9 |
25.9 |
25.9 |
29.8 |
||
| 4 |
26.4 |
26.2 |
26.3 |
30.4 |
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=“4.18”J/(g·℃)。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中Na2CO3的质量分数。
【方案一】 称取一定质量的固体样品,通过加热至恒重后冷却,称量剩余固体质量,计算。
(1)下列仪器中,在灼烧固体样品时必须用到的是 (填名称)。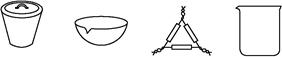
(2)实验中需加热至恒重的目的是: 。
(3)实验中确定加热至恒重的方法是: 。
(4)若加热过程中有晶体迸溅出来,则测得的结果 (填“偏大”、“偏小”或“不变”)。
【方案二】 称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(已知:Ba2++OH-+HC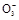
 BaCO3↓+H2O)
BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为 。
(2)实验中判断沉淀是否完全的方法是 。
(3)实验中洗涤沉淀的操作是 。
(4)实验中判断沉淀是否洗涤干净的方法是 。
【方案三】 按如图所示装置进行实验:
(1)B装置内所盛试剂是 ;D装置的作用是 ;分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9 g样品,实验后测得C装置增重8.8 g,则样品中Na2CO3的质量分数为 。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是 。
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器a的名称为 ;仪器b中可选择的试剂为 。
(2)实验室中,利用装置A,还可制取的无色气体是 (填字母)。
| A.Cl2 | B.O2 | C.CO2 | D.NO2 |
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体产生,上述现象证明NH3具有 性,写出相应的化学方程式: 。
(4)E装置中浓硫酸的作用是 。
(5)读取气体体积前,应对装置F进行的操作: 。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为 (用含m、n字母的代数式表示)。
化学实验要符合“绿色化学”理念。某实验小组对“铜与浓硝酸反应”进行了探究性实验。试回答下列问题: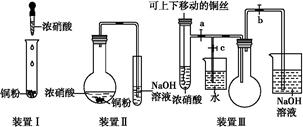
(1)写出铜和浓硝酸反应的离子方程式:。
(2)与装置Ⅰ相比,装置Ⅱ的优点是,装置Ⅲ除具有装置Ⅱ的优点外,还有的优点是。
(3)在装置Ⅲ中,若使NO2气体充满烧瓶,应先关闭弹簧夹 ,再打开弹簧夹 ;当气体充满烧瓶后,将铜丝提起,然后把a、b、c都关闭,并把烧瓶置于沸水中,下列情况不变的是 。
| A.颜色 |
| B.质量 |
| C.气体的平均相对分子质量 |
| D.密度 |
E.压强
(4)为了验证NO2与水的反应,欲使烧杯中的水进入烧瓶的操作是。