在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1 L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g·mol-1) |
| 蔗糖 |
50.00 |
342 |
| 硫酸钾 |
0.50 |
174 |
| 阿司匹林 |
0.35 |
180 |
| 高锰酸钾 |
0.50 |
158 |
| 硝酸银 |
0.04 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A.蔗糖 B.硫酸钾
C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)_____________mol·L-1。(保留两位有效数字)
(3)配制上述1 L“鲜花保鲜剂”所需的仪器有托盘天平、烧杯、玻璃棒、药匙、________、________。(在横线上填写所缺仪器的名称)
(4)配制过程中,下列操作对配制结果没有影响的是__________。
A.定容时仰视液面
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中。
(2)用滴定管向A仪器中滴加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为V cm3。
①步骤(1)中A仪器最好用__________(仪器名称)。
②步骤(2)中用酸式滴定管好还是碱式滴定管好,__________,理由是______________
________________。
③能否用胶头滴管代替步骤(2)中的滴定管__________;理由是____________________。
④已知NaCl晶体的结构如上图所示,用X射线测得NaCl晶体中靠得最近的Na+与Cl-间的平均距离为a cm,则用上述测定方法测得阿伏加德罗常数Na的表达式为Na=
__________。
优良的有机溶剂对孟烷、耐热型特种高分子功能材料
的合成路线如下:
己知芳香化合物苯环上的氢原子可被卤代烷中的烷基取代。如:
(1)
为芳香烃。
①由
生成对孟烷的反应类型是。
②
与
生成
的化学方程武是。
③
的同系物中相对分子质量最小的物质是。
(2) 1.08g的
与饱和溴水完全反应生成3.45 g白色沉淀。
不能使
的
溶液褪色.
①F的官能团是。
②C的结构简式是。
③反应I的化学方程式是。
(3)下列说法正确的是(选填字母)()
a.
可使酸性高锰放钾溶液褪色 b.
不存在醛类同分异构体
c.
的酸性比
弱 d.
的沸点高于对孟烷
(4)
的核磁共振氢谱有3种峰,其峰面积之比为3:2:1。
与
反应放出
。反应II的化学方程式是。
用
生产某些含氯有机物时会产生副产物
。利用反应
,可实现氯的循环利用。
反应
: 4
+
 2
+2
2
+2
(1)已知:i 反应
中, 4
被氧化,放出115.6
的热量。
ii
①
的电子式是.
②反应
的热化学方程式是。
③断开1
键与断开1
键所需能量相差约为
中
键比
中
键(填"强"或"弱")。
(2)对于反应
,下图是4种投料比[
,分别为1:1、2:1、4:1、6:1]下,反应温度对
平衡转化率影响的曲线。
①曲线
对应的投料比是.
②当曲线
、
、
对应的投料比达到相同的
平衡转化率时,对应的反应温度与投料比的关系是.
⑧投料比为2:1、温度为400
时,平衡混合气中
的物质的量分数是.
直接排放含
的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的
,
(1)用化学方程式表示
形成硫酸型酸雨的反应:。
(2)在钠碱循环法中,
溶液作为吸收液,可由
溶液吸收
制得,该反应的离子方程式是
(3)吸收液吸收
的过程中,
随
变化关系如下表:
| 91:9 |
1:1 |
1:91 |
|
| 8.2 |
7.2 |
6.2 |
①上表判断
溶液显性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.
,
b.
c.
(4)当吸收液的
降至约为6时,需送至电解槽再生。再生示意图如下: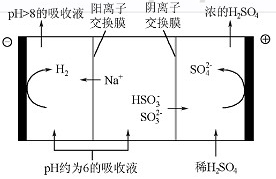
①
在阳极放电的电极反应式是。
②当阴极室中溶液
升至8以上时,吸收液再生并循环利用。简述再生原理:
某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有SiO2、A12O 3等杂质)提取Fe2O3。操作讨程如下: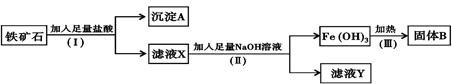
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是;
(2)沉淀A中主要含有,固体B是;
(3)滤液Y中的阴离子除OH-、Cl-外,还有;
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式。