下列有关作用力的说法正确的是( )
| A.金属键、离子键、分子间作用力都没有方向性和饱和性 |
| B.键能、金属的原子化热、晶格能分别可以衡量氢键、金属键、离子键的强弱 |
| C.离子键、金属键、氢键、范德华力本质上都是静电作用 |
| D.乙酸、丙醇、丙酮的沸点都比丁烷高是因为前三者分子间都存在氢键 |
下述实验不能达到预 期目的的是
期目的的是
| 编号 |
实验内容 |
实验目的 |
| A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有漂白性 |
| B |
将Cl2通入NaBr溶液中,然后加入CCl4,振荡、静置 |
比较氯与溴的氧化性强弱 |
| C |
将铜片分别与浓、稀硝酸反应 |
探究浓、稀硝酸氧化性的相对强弱 |
| D |
向盛有20g蔗糖的烧杯中加入几滴水,搅拌均匀。再加入少许浓硫酸,迅速搅拌。 |
探究浓硫酸的脱水性 |
把500 ml有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
| A.0.1(b-2a)mol·L-1 | B.10(2a - b)mol·L-1 |
| C.10(b-a)mol·L-1 | D.10(b-2a)mol·L-1 |
在1000K时,下列可逆反应达到平衡:CO(g)+H2O(g)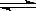 CO2(g)+H2(g);已知CO和H2O的起始浓度均为0.01mol/L,H2的平衡浓度为0.005mol/L。此时,若再充入水气0.02mol/L,使平衡移动,H2的新平衡浓度可能是
CO2(g)+H2(g);已知CO和H2O的起始浓度均为0.01mol/L,H2的平衡浓度为0.005mol/L。此时,若再充入水气0.02mol/L,使平衡移动,H2的新平衡浓度可能是
| A.0.0025mol/L | B.0.0075mol/L | C.0.01mol/L | D.0.015mol/L |
氯化铵晶体溶于重水中,溶液呈现出酸性,下列说法正确的是
| A.NH4+水解生成NH3.H2O和HD2O+ |
| B.NH4+水解生成NH3.DHO和H2DO+ |
| C.NH4+水解生成NH3.D2O和H2DO+ |
| D.NH4+水解生成NH3.DHO和D3O+ |
以NA表示阿伏加德罗常数,下列说法正确的是
| A.0.1mol Fe与足量盐酸反应,转移的电子数为0.3NA |
| B.28gCO中所含的原子数为2NA |
| C.0.1mol/LNa2CO3溶液中,含有CO32— 数为0.1NA |
| D.标况下,22.4L苯的分子数为NA |