有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示.请回答下列问题.
(1)E元素原子基态时的电子排布式为________.
(2)A2F分子中F原子的杂化类型是________,F的氧化物FO3分子空间构型为________.
(3)CA3极易溶于水,试判断CA3溶于水后,形成CA3·H2O的合理结构:________(填字母代号),推理依据是_________________________.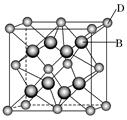
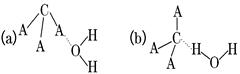
(4)从图中可以看出,D跟B形成的离子化合物;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是______________________(写出表达式即可).
通常,烷烃可以由相应的烯烃经催化加氢得到。有一种烷烃A,分子式是C9H20,它却不能由任何C9H18的烯烃催化加氢得到;而另有A的三个同分异构体B、C、D,却分别可由而且只能由1种相应的烯烃催化加氢得到。A及另外三种同分异构体的结构简式分别是:_______________、_________________、________________、_______________。
吗啡和海洛因都是严格查禁的毒品,吗啡分子中C、H、N的质量分数依次为715.8%、6.67%、4.91%,其余为氧。
(1)写出吗啡的化学式:________________________,并计算其相对分子质量(已知吗啡的相对分子质量不超过300):_________。
(2)已知海洛因是吗啡的二乙酸酯,则海洛因的相对分子质量为_________,化学式为__________________。
取3.40 g只含羟基,不含其他官能团的液态饱和多元醇,置于5.00 L氧气中,经点燃,醇完全燃烧。反应后气体体积减少0.56 L。将气体经足量NaOH溶液吸收,体积又减少2.80 L(所有体积均在标准状况下测定)。
(1)3.40 g醇中C、H、O物质的量分别为C_________mol,H_________mol,O_________mol,该醇中C、H、O的原子数之比为_________。
(2)由以上比值能否确定该醇的化学式?_________,其原因是______________________。
(3)如果将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,试写出该饱和多元醇的结构简式:__________________。
有机化合物分子中,与4个不同的原子或基团相连的碳原子称作“手性”碳原子。例如,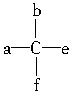 中a、b、e、f均不相同,C为“手性”碳原子。则分子式为C4H10O的有机化合物中,含有“手性”碳原子的结构为___________________________。
中a、b、e、f均不相同,C为“手性”碳原子。则分子式为C4H10O的有机化合物中,含有“手性”碳原子的结构为___________________________。
已知某种有机物X有如下性质:①X不和碳酸氢钠反应;②X的蒸气对H2的相对密度为46.0;③取1.84 gX与过量的金属钠完全作用后,生成672 mL(标准状况)气体;④一定质量的X完全燃烧后,产生的气体依次通过浓硫酸和碱石灰,使两者的质量分别增加36.0 g和66.0 g,则X的结构简式为__________________。