测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800毫升烧杯、100毫升量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19克/毫升)、水。按图示装置进行实验,回答下列问题。(设合金样品完全反应,产生的气体体积不超过100毫升)
(1)补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在800毫升烧杯底部,把短颈漏斗倒扣在样品上面。
②_______________________________________
③_______________________________________
④_______________________________________
(2)合金样品用铜网包裹的目的是:_______________________________________
某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.在250 mL容量瓶中定容成250 mL烧碱溶液; |
| B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴加几滴甲基橙作指示剂; |
| C.在天平上准确称取烧碱样品m g,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为c mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1 mL; |
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL。
回答下列问题:
(1)正确操作步骤的顺序是(用字母填写) 

 D
D  。
。
(2)操作D中液面应调整到 。
(3)滴定终点的现象是。
(4)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响?(填“偏高”、“偏低”或“无影响”,其它操作均正确)。
(5)该烧碱样品的纯度计算式是。
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下(已知2KI+Cl2===2KCl+I2,碘与溴一样易溶于有机溶剂):
(1)指出提取碘的过程中有关的实验操作名称:①________,③________。
(2)提取碘的过程中,可供选择的有机试剂是________。
A.苯 B.四氯化碳 C.酒精
(3)为使上述流程中含碘离子溶液转化为碘的有机溶液,实验室里有烧杯、玻璃棒以及必要的夹持仪器,尚缺少的玻璃仪器是。
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图所示实验装置中的错误之处:
①。
②。
③。
(5)进行上述蒸馏操作时使用水浴的原因是。
(6)四氯化碳是____色液体。如果本实验用苯做萃取剂,则上层液体的颜色为色,下层液体中溶质的主要成分为___________(写化学式)。
某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究。
【提出假设】:小组同学经过分析讨论认为生成气体可能含H2和SO2。
【设计实验方案,验证假设】主要包括两个环节:
Ⅰ.验证SO2,实验装置如图所示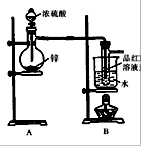
Ⅱ.检验产物中含有H2,实验内容将由B部分导出的气体依次通过装置C、D、E、F、G。Ⅱ中装置C、D、E、F、G的信息如下表所示:
| 仪器标号 |
C |
D |
E |
F |
G |
| 仪器 |
洗气瓶 |
洗气瓶 |
硬质玻璃管,加热 |
干燥管 |
干燥管 |
| 仪器中所加物质 |
NaOH溶液 |
浓硫酸 |
CuO粉末 |
试剂X |
无水CaCl2固体 |
试回答下列问题:
(1)小组同学认为生成气体中含H2的理由是;
(2)盛放锌粒的仪器名称是;
(3)B部分装置的目的是验证SO2并探究SO2与品红作用的可逆性,实验的操作及主要现象是;
(4)①装置D、G的作用依次是、;
②E中发生反应的化学方程式是;
③试剂X是。
实验室可用MnO2和KClO3混合加热的方法制取氧气。现有下列仪器或装置:
Ⅰ.(1)A~D装置中,用作KClO3为原料制氧气的反应装置是(填序号);
(2)排水法收集氧气,接口顺序是:氧气出口→→→g→h→烧杯(填序号)。
Ⅱ.KClO3分解时尚有副反应,导致收集到的气体有异味.据推测,副产物可能是O3、Cl2、ClO2中的一种或几种.资料表明:O3、Cl2、ClO2的沸点依次为-111℃、-34℃和11℃,且O3、ClO2也能将KI氧化为I2.为探究副反应气体产物的成分,将KClO3分解产生的气体经干燥后通入下图装置进行实验:
(3)若要确认副产物中含Cl2,F中应盛放溶液。
(4)确定副产物中含有ClO2的现象是。
(5)实验时若D中无现象,E中试纸变蓝,能否得出副产物含有O3的结论?理由是。
Ⅲ.ClO2是饮用水消毒剂.用ClO2处理过的饮用水(pH为5.5~6.5)除含有ClO2外,常含有一定量对人体不利的ClO2-.为测定此饮用水中两者成分,进行如下实验:准确量取VmL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I-═I2+2ClO2-,反应结束后产生amol I2;继续调节溶液pH=1,又发生如下反应:ClO2-+4H++4I-═2I2+Cl-+2H2O,反应结束后叉产生b mol I2。
(6)饮用水中c(ClO2-)=mol•L-1(用含字母的代数式表示)。
研究性学习小组用Na2SO3与硫酸溶液(硫酸与水体积比1:1)制备SO2并进行性质探究实验。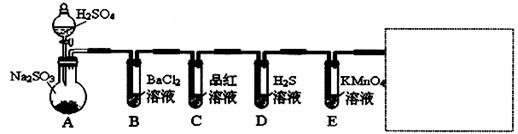
(1)D中的实验现象是:________________,C,E中溶液都褪色,分别体现SO2__________性质。
(2)请在方框中画出收集SO2以及尾气处理装置(标相关试剂)
(3)研究小组发现B中有白色沉淀,为了清楚沉淀的物质,研究小组往B中加入过量稀盐酸,沉淀不溶解,你认为留下的沉淀物是______________,形成该沉淀的总反应的离子方程式为:_____________
为了进一步验证沉淀原因,研究小组另取BaCl2溶液,加热煮沸,冷却及时加入少量苯液封,然后再通SO2,结果发现沉淀量减少,但仍有轻微浑浊。研究小组改进A装置(如图),再进行试验,B中没有出现浑浊。下列气体可以作为X气体的是________(填序号,不定项选择)
| A.CO2 | B.NH3 | C.O3 | D.N2 E.NO2 |
(4)SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况),缓慢通过足量溴水中,在所得溶液中加入过量BaCl2溶液,将产生的白色沉淀洗涤,干燥,用电子称称其质量为0.233g,则:
①沉淀洗涤要干净,检验洗涤沉淀已经干净的实验操作是_______________________.
②试计算此空气中SO2的浓度(列出计算表达式并计算结果,结果单位用mg/m3表示)。__________。