某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4==Li2Mn2O4。下列说法正确的是
| A.放电时,Li发生还原反应 | B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4 |
| C.充电时,LiMn2O4发生氧化反应 | D.充电时,阳极反应为:Li++e-==Li |
下列与化学反应能量变化相关的叙述正确的是
| A.生成物能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.由盖斯定律可计算某些难以直接测量的反应焓变 |
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的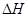 不同 不同 |
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
下列判断不正确的是
| A.该反应的△S>0 | B.K(1000℃)>K(810℃) |
| C.b<f | D.915℃、2.0MPa时E的转化率为80% |
已知2SO2(g) + O2 (g)  2SO3(g),△H1=-414KJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3;恒温、恒容下反应达平衡时,三个密闭容器中下列关系一定正确的是
2SO3(g),△H1=-414KJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3;恒温、恒容下反应达平衡时,三个密闭容器中下列关系一定正确的是
| A.容器内压强p:p甲=p丙>2p乙 |
| B.c(SO2)与c(O2)之比k:k甲=k丙>k乙 |
| C.SO3的质量m:m甲=m丙>2m乙 |
| D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙 |
一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g)  3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%(不考虑无关气体的量)的是
3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%(不考虑无关气体的量)的是
A.1molB和1molC B.2molA、2molB和1molHe(不参加反应)
C.2mol C D.2molA、3molB和3molC
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是