某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子浓度一定都降低
②pH=2的盐酸和pH=1的盐酸, 之比为2:1
之比为2:1
③pH相等的四种溶液:a.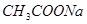 ;b.
;b.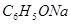 ;c.
;c.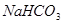 ;d.
;d.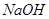 。其溶液物质的量浓度由小到大顺序为d、b、c、a
。其溶液物质的量浓度由小到大顺序为d、b、c、a
④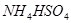 溶液中滴加NaOH溶液至溶液pH=7,则
溶液中滴加NaOH溶液至溶液pH=7,则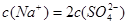
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为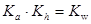
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
| A.③⑤⑥ | B.③④⑥ | C.④⑤⑥ | D.①②④ |
放射性同位素钬的质量数A=166,质子数Z=67,则中子数与核外电子数之差为
| A.166 | B.67 | C.99 | D.32 |
下列叙述错误的是
| A.乙烯和苯都能使溴水褪色,褪色的原因相同 |
| B.淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| D.乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(X)与溶液中沉淀物的量(Y)的关系示意图中正确的是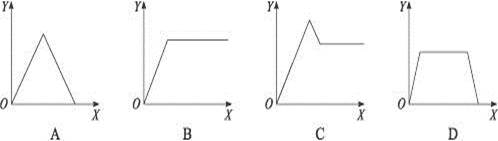
下列变化,需要加入适当的氧化剂才能完成的是
| A.CuO→Cu | B.Cu(OH)2→CuCl2 |
| C.H2SO4→CuSO4 | D.SO2→ SO3 |
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.4.4gCO2和N2O混合物所含原子数为0.3NA |
| B.一定温度下,6.72LCl2与11.2gFe粉反应转移电子数为0.3 NA |
| C.50mL18mol/L硫酸与足量的Cu粉反应产生10.08L气体 |
| D.标准状况下,4g氦气中所含的原子数为0.5NA |