某主族元素的离子X2+外围电子层排布为6S2,当把X的最高价氧化物溶于浓盐酸时,有黄绿色气体产生,则下列说法不正确的是( )
| A.X2+具有还原性 | B.X的最高价氧化物具有强氧化性 |
| C.该元素是第ⅥA族元素 | D.X的+2价化合物比+4价化合物稳定 |
水的电离平衡为H2O H+﹢OH-,△H>0,下列叙述不正确的是
H+﹢OH-,△H>0,下列叙述不正确的是
| A.将水加热,pH减小 |
| B.恒温下,向水中加入少量固体KOH,Kw不变 |
| C.向水中滴入稀醋酸,c(H+)增大 |
| D.向水中加入少量固体NaClO,平衡逆向移动 |
室温下,向20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是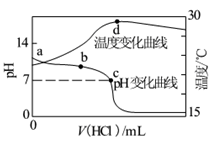
| A.氨水的电离程度a>b>c |
| B.a、d两点的溶液,水的离子积Kw(a)>Kw(d) |
| C.c点时消耗盐酸体积V(HCl)<20 .00ml |
| D.d点时溶液温度达到最高,之后温度略有下降,原因是NH3·H2O电离吸热 |
用标准的NaOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是
| A.盛装标准液的滴定管未用标准液润洗 |
| B.滴定终点读数时,仰视滴定管的刻度,其他操作正确 |
| C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 |
| D.滴定前无气泡,滴定到终点时,发现尖嘴处有气泡 |
用已知浓度的NaOH滴定未知浓度的HCl溶液时,正确的操作顺序是
①用水洗净滴定管
②将滴定管进行检漏
③用待装液润洗滴定管后装液
④调整起始读数并记录
⑤向锥形瓶中加入指示剂
⑥用标准液进行滴定
⑦从酸式滴定管中取一定体积的待测液
⑧记录滴定终点读数并重复实验2~3次
| A.①②③④⑤⑥⑦⑧ | B.①②③④⑦⑤⑥⑧ |
| C.②①③④⑦⑤⑥⑧ | D.②①③④⑤⑥⑦⑧ |
若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
| A.Al3+ Na+NO3- Cl- | B.K+ Na+Cl- NO3- |
| C.K+Na+ Cl-AlO2- | D.K+ NH4+ SO42-NO3- |