(14分)随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分CH4)为原料经合成气(主要成分CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。
请问答下列问题:
(1)Fe(CO)5中铁的化合价为0,写出铁原子的基态电子排布式
(2)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式),CO分子的结构式可表示成 。
(3)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断Fe(CO)5晶体为 晶体。
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 ,CH3OH的熔、沸点比CH4的熔、沸点比高,其主要原因是 。
实验是化学研究的一种重要手段,现有下图所示A~G七种仪器,请根据要求填空。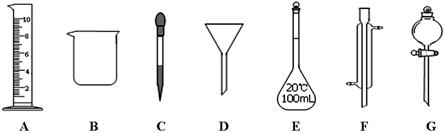
(1)写出仪器名称:B,F
(2)下列实验操作中用到仪器G的是(选填下列选项的编号字母)。
a.分离水和CC14的混合物 b.分离水和酒精的混合物 c.分离水和泥砂的混合物
(3)实验室配制100mL 0.5mol/L的盐酸溶液。
①下列关于仪器E的使用方法中,正确的是(选填下列选项的编号字母)。
a.使用前应检查是否漏液 b.使用前必须烘干
c.不能用作物质反应或溶解的容器 d.热溶液可直接转移到容量瓶中
②需用10mol/L的浓盐酸mL。取用该体积盐酸时,需要用到上述仪器中的A和(选填仪器的编号字母)。
③在实验时,按下列步骤“计算→量取→溶解→转移→定容→保存到试剂瓶中”进行配制,定容后,液面位置(如下左图)正确的是(选填下列选项的编号字母)。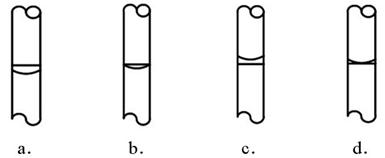

④请在试剂瓶标签上填写相应内容(盛放上述配制好的溶液)[(标签如上右图)]。
化学是一门以实验为基础的科学,根据题中实验要求,请选择合适的实验操作,将其标号填入对应的空格中。
| 序号 |
实验目的 |
实验方法 |
| ① |
证明米汤中含有淀粉 |
|
| ② |
证明碳酸钠溶液呈碱性 |
|
| ③ |
除去Fe2O3中的Al2O3 |
|
| ④ |
证明粗盐中含有少量Ca2+ |
供选择的实验操作:
A.加入Na2CO3溶液,观察现象
B.用玻璃棒蘸取溶液点在pH试纸中部,对照比色卡
C.加入碘水,观察溶液颜色变化
D.加入氢氧化钠溶液,过滤
(1)一定温度下,向4L密闭容器中加入1molHI(g),发生2HI(g) H2(g)+I2(g),H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)=mol/(L·min)。
H2(g)+I2(g),H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)=mol/(L·min)。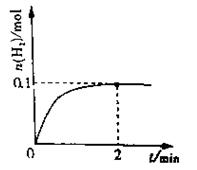
(2)①某温度下,反应SO2(g)+ 1/2O2(g)  SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)  2SO2(g) + O2(g)的平衡常数K2的值为。
2SO2(g) + O2(g)的平衡常数K2的值为。
(3)某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量)。则该反应的化学平衡常数:
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量)。则该反应的化学平衡常数:
K=。(列出算式,代入数据即可)
(4)下图表示373K时,反应A(g)  2B(g)在前110s内的反应进程。
2B(g)在前110s内的反应进程。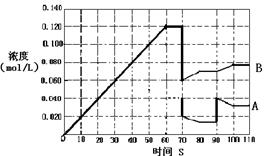
①373K时反应进行到70s时,改变的条件可能是________,反应进行到90s时,改变的条件可能是_____。
| A.加入催化剂 | B.扩大容器体积 | C.升高温度 | D.增大A的浓度 |
②请在图中画出反应物A在0~70秒时的浓度变化曲线。
(1)高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g)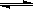 2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:
2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:
①该反应的△H_____0(填“>”、“<”或“=”);
②在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求CO的平衡转化率= ________。
(2)常温下,HR(酸)溶液pH=3,MOH(碱)的溶液pH=11,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式
___________________________________________。
(3)25℃时,pH=0的HCl、0.1mol/L的HCl、0.01mol/L的NaOH、pH=14的NaOH四种溶液中由水电离产生的c(H+)之比为。
(4)已知25℃时,电离常数Ka(HF)=3.6×10-4,则0.1 mol·L-1 HF溶液中c(H+)=mol·L-1。
(1)氯元素的最高价氧化物为无色液体,0.25 mol 该物质与一定量水混合得到一种稀溶液,并放出Q kJ 的热量。写出该反应的热化学方程式:。
(2)已知:Fe2O3(s) + 3/2C(s) = 3/2CO2(g) + 2 Fe(s) ΔH =234.1 kJ·mol-1
C(s) + O2(g) = CO2(g)ΔH = —393.5 kJ·mol-1
则2 Fe(s)+ 3/2O2(g) = Fe2O3(s) 的ΔH是kJ·mol-1。
(3)意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示。已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ。根据以上信息和数据,写出N4气体转变为N2的热化学方程式:。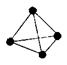
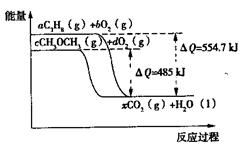
(4)下图是丙烷(C3H8)、二甲醚(CH3OCH3)燃烧过程中能量变化图,其中x为各自反应中对应的系数。根据该图写出二甲醚燃烧的热化学方程式:。