某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:
在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:
向实验①的溶液中加入4 mL 0.5 mol/L的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式 。
(2)实验②中化学反应转移电子的物质的量是 。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是_________________。
【化学—化学与技术】
铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作______________剂。
(2)自然界中Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出过程中的离子方程式:。
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下: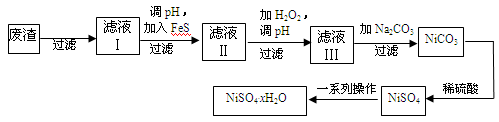
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为。
②对滤液Ⅱ先加H2O2再调pH,加H2O2的目的是,调pH的目的是。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是。
铜是与人类关系非常密切的有色金属。已知:常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生反应:2Cu+ =Cu2++Cu。大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等。
(1)在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成不溶物的颜色为:,某同学实验时却有黑色物质出现,这种黑色物质的化学式为:。
(2)在CuCl2溶液中逐滴加入过量KI溶液可能发生:
a.2Cu2++4I- =2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I- =2CuCl↓(白色)+I2。
为顺利观察到白色沉淀可以加入的最佳试剂是。
| A.SO2 | B.苯 | C.NaOH溶液 | D.乙醇 |
(3)一定条件下,在CuSO4中加入NH5反应生成氢化亚铜(CuH)。
①已知NH5是离子晶体且所有原子都达到稀有气体的稳定结构,请写出NH5的电子式:。
②写出CuH在过量稀盐酸中有气体生成的离子方程式。
③将CuH溶解在适量的稀硝酸中, 完成下列化学方程式
(4)常温下,向0.20 mol • L-1硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜沉淀,当溶液的pH = 6时,c(Cu2+)=________________mol.L‑1。
[已知:
 ]
]
I.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)
(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_________________________________________。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:
| t/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
请完成下列问题。
①试比较K1、K2的大小,K1___________K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是______________(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正______________v(N2)逆(填写“>”、“=”或“<”)。
II.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。
| 酸或碱 |
电离平衡常数(Ka或 Kb) |
| CH3COOH |
1.8×10-5 |
| HNO2 |
4.6×10-4 |
| HCN |
5×10-10 |
| HClO |
3×10-8 |
| NH3·H2O |
1.8×10-5 |
请回答下列问题:
(1)上述四种酸中,酸性最弱的是_________________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是_________________(填序号)。
A.升高温度B.加水稀释
C.加少量的CH3COONa固体D.加少量冰醋酸
(2)CH3COONH4的水溶液呈____(选填“酸性”“中性”或“碱性”),理由是:__________________________,溶液中各离子浓度大小的关系是__________________________________。
(本题共12分)
奈必洛尔是一种用于血管扩张的降血压药物。用于合成奈必洛尔中间体G的部分流程如下:
已知:乙酸酐的结构简式为
49.G物质中的含氧官能团的名称是、
50.反应A→B的化学方程式为
51.写出反应类型,④、⑤
52.写出二个满足下列条件的C的同分异构体的结构简式
I.苯环上只有两种取代基。
II.分子中只有4种不同化学环境的氢。
III.能与NaHCO3反应生成CO2。
53.根据已有知识并结合相关信息,写出以 和乙酸酐为原料制备
和乙酸酐为原料制备 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
(本题共8分)
化合物E是一种化工产品,可以通过下图所示的路线合成:
已知:
45.化合物II的结构简式为:
46.写出化合物III与新制氢氧化铜反应的化学方程式:
47.下列说法正确的是
| A.化合物I遇氯化铁溶液能显色 |
| B.化合物II能与NaHCO3溶液反应 |
| C.1mol化合物III最多能与3mol H2反应 |
| D.1mol化合物E完全燃烧消耗9.5mol O2 |
48.有机物R(C9H9ClO3)经过反应也可制得化合物E,则R在NaOH醇溶液中反应的化学方程式为。