细菌冶金是一种新工艺,其能耗少、减少环境污染.称为“绿色冶金”。其原理:①氧化硫硫杆菌和聚硫杆菌能把矿石中的硫氧化成硫酸,反应式为2S+3O2+2H2O 2H2SO4,②氧化亚铁硫杆菌在上面产生的硫酸中能把硫酸亚铁氧化成硫酸铁③细菌得到了所需要的能量,生成的硫酸铁可把FeS2(黄铁矿)和Cu2S(辉铜矿)等转变为可溶性化合物而从矿石中溶解出来,其化学过程是:
Fe2S2(黄铁矿)+7Fe2(SO4)3+8H2O 15FeSO4+ 8H2SO4
Cu2S(辉铜矿)+2Fe2(SO4)2 2CuSO4+4FeSO4+S
(1)写出②反应的化学方程式: 。
(2)某实验小组,欲将硫酸铜和硫酸亚铁的酸性混合液分离出硫酸亚铁溶液.经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如表2
| 物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀pH |
6.0 |
7.5 |
1.4 |
| 沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择A.H2O2 B.CaO C.CuO D.稀H2SO4 E.铁粉;
实验经过滤后还需设计的实验操作步骤和目的是:
| 实验步骤 |
实验操作 |
实验操作的目的 |
| 步骤1 |
|
|
| 步骤2 |
|
|
| 步骤3] |
|
|
| 步骤4 |
洗涤 |
|
| 步骤5 |
|
得到FeSO4溶液 |
(3)若向CuSO4、FeSO4混合液中加入适量碱液,将溶液蒸干、灼烧得到红色粉末是Fe2O3、Cu2O混合物,欲测定该混合物中Cu2O的质量分数。该实验小组的方法是向m g混合物中加人足量的稀硫酸,经过滤、洗涤、干燥、称量固体的质量为n g。已知Cu2O溶于稀硫酸生成Cu和CuSO4。某学生据此计算出该混合物Cu2O的质量分数的计算式 。该学生的计算是否正确: ,请说明理由 。
。该学生的计算是否正确: ,请说明理由 。
Ⅰ.下列有关操作正确的是_。
①FeBr3作催化剂,苯和溴水发生反应可生成无色、比水重的液体溴苯
②将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,实现乙醇被氧化为乙醛的实验
③用Cu和Ag作为两极,H2SO4溶液作为电解质溶液,可以构成原电池
④为了防止自来水管生锈,一般在表面镀上一层Zn
⑤使用AgNO3溶液验证三氯甲烷中是否含有氯元素,现象是产生白色沉淀
A.②④B.①②C.③⑤D.④⑥
Ⅱ. 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用
是:。
(2)已知下表数据:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/(g/cm3) |
| 乙醇 |
-144 |
78 |
0.789 |
| 乙酸 |
16.6 |
117.9 |
1.05 |
| 乙酸乙酯 |
-83.6 |
77.5 |
0.90 |
| 浓硫酸 |
—— |
338 |
1.84 |
①按装置图安装好仪器后,需要试剂为3 ml 乙醇,2 ml乙酸,适量浓硫酸,请选择合适的加入顺序。
A. 先加浓硫酸,再加乙醇,最后加乙酸
B. 先加乙醇,再加浓硫酸,最后加乙酸
C. 先加乙酸,再加浓硫酸,最后加乙醇
D. 先加浓硫酸,再加乙酸,最后加乙醇
②根据上表数据分析,为什么乙醇需要过量一些,其原因是。
(3)按正确操作重新实验,该学生很快在小试管中收集到了乙酸乙酯、乙酸、乙醇的混合物。现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。在图中圆括号表示加入适当的试剂,编号表示适当的分离方法。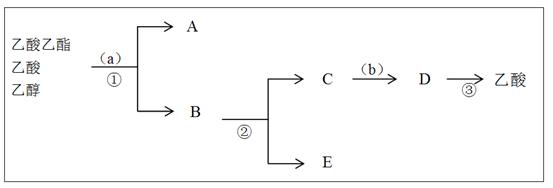
①写出加入的试剂名称: 试剂(a)是;试剂(b)是。
②写出有关的操作分离方法:①是,②是,③是。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液。以0.14mol/L的NaOH溶液滴定上述稀H2SO4 25mL,滴定终止时消耗NaOH溶液15mL,其操作分解为如下几步:
| A.移取稀H2SO4 25.00 mL,注入洁净的锥形瓶中,并加入2-3滴指示剂。 |
| B.用蒸馏水洗涤滴定管,后用标准溶液润洗2-3次。 |
| C.取标准NaOH溶液注入碱式滴定管至 “0”或“0”刻度线以上。 |
| D.调节液面至 “0”或“0”以下某一刻度,记下读数。 |
E.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液。
F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点,记下滴定管液面读数。
就此实验完成填空:
(1)①滴定操作的正确顺序是(用序号填写)。
②该滴定操作中应选用的指示剂是。
③在F操作中如何确定终点?。
(2)该滴定过程中,造成测定结果偏高的原因可能有哪些。
①配制标准溶液的NaOH中混有Na2CO3杂质
②滴定终点读数时,俯视滴定管的刻度,其他操作正确
③ 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
④滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
⑤滴定前碱式滴定管尖嘴部分未充满溶液
⑥滴定中不慎将锥形瓶内液体摇出少量于瓶外
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度 mol/L(保留2位小数)
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
P H=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________ (选填“是”或“否”)。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________。
某溶液中可能含有A13+、NH4+、Fe2+、CO32-、SO42-、C1-中的一种或几种,取该溶液进行以下连续实验:
(1)取溶液少量于试管中,测得溶液的pH为2,则溶液中不存在的离子是______________。
(2)继续向溶液中加入过量Ba(NO3)2溶液,有沉淀生成,同时有气体放出,写出产生气体的离子方程式。
(3)取(2)中的上层清液,加入过量NaOH溶液,有沉淀、气体生成,此沉淀和气体的化学式为、。
(4)继续向(3)中反应后的剩余溶液中通入足量CO2气体,又有白色沉淀生成,则原溶液中存在的离子是。
(5)上述实验中还不能确定是否存在的离子是。
某校化学研究性学习小组欲设计实验验证Al、Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制
_____________ 、_____________ 相同;若选用一种盐溶液验证三种金属的活泼性,该试剂为。
(2)①若用Fe、Cu作电极设计成原电池,以确定Fe、Cu的活动性。试在下面方框中画出原电池装置图,标出原电池的电极材料和电解质溶液。
上述装置中正极反应式为。
②某小组同学采用Al、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用。
| A.0.5 mol·L-1氯化亚铁溶液 | B.0.5 mol·L-1氯化铜溶液 |
| C.0.5 mol·L-1盐酸 | D.0.5 mol·L-1氯化亚铁和0.5 mol·L-1氯化铜混合溶液 |
(3)利用提供的试剂和用品:0.1 mol·L-1盐酸溶液、0.1 mol·L-1醋酸溶液、0.5 mol·L-1氯化铝溶液、0.5 mol·L-1氢氧化钠溶液、PH试纸。
请设计最简单实验证明氢氧化铝为弱碱