海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图。
按要求回答问题:
(1)浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,可供提取利用的有50多种。下列物质不需要通过化学变化就能够从海水中获得的是 。
A.食盐 B.金属钠 C.淡水
(2)以电解食盐水为基础制取Cl2、 等产品的工业称为“氯碱工业”。
(3)实验室制取氯气的反应原理为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气 (填写装置的序号)。
MnCl2+Cl2↑+2H2O;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气 (填写装置的序号)。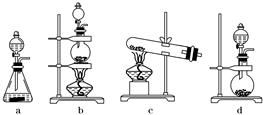
(4)实验室中模拟Br—→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现。写出Br—→Br2的转化离子方程式为: ;氯水不稳定,要现用现配,下列吸收氯气制备氯水的装置最合理的是 (选填下列选项的编号字母)。
(5)电解熔融氯化镁所得的镁蒸气冷却后即为固体镁。下列气体中,镁蒸气可以在其氛围中冷却的是 (选填下列选项的编号字母)。
A.Cl2 B.N2 C.Ar D.空气 E.H2
(6分)(1)用18.0 mol/L H2SO4配制100 mL 1.00mol/L H2SO4,则需要的实验仪器除了烧杯、玻璃棒、胶头滴管以外还应该有:______
配制过程中,下列情况会使配制结果偏高的是(填序号)____
①定容是俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度
④容量瓶盛过H2SO4溶液,使用前未洗涤
(2)在容量瓶使用方法中,下列操作不正确的是(填字母)_________
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C .配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
D.盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转摇匀
用A、B、C三种装置都可制取溴苯。请仔细分析三套装置,然后回答下列问题:
(1)写出三个装置中都发生反应的化学方程式:、 ;写出B的试管中还发生的反应化学方程式;
;写出B的试管中还发生的反应化学方程式;
(2)装置A、C中长导管的作用是;
(3)B、C装置已连接好,并进行了气密性检验,也装入了合适的药品,接下来要使反
应开始,对B应进行的操作是,对C应进行的操
作是;
(4)A中存在 加装药品和及时密封的矛盾,因而在实验中
加装药品和及时密封的矛盾,因而在实验中 易造成的不良后果是
易造成的不良后果是
。
某兴趣小组同学在实验室用加热l-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,设计了如下图所示的实验装置(其中的夹持仪器没有画出)。
请回答下列问题:
(1)A装置中,在烧杯里的液面倒扣一个漏斗,其目的是▲。
(2)制备操作中,加入的浓硫酸事先必须进行稀释,其目的是▲。(填字母)
a.减少副产物烯和醚的生 成 b.减少Br2的生成c.水是反应的催化剂
成 b.减少Br2的生成c.水是反应的催化剂
(3)有同学拟通过红外光谱仪鉴定所得产物中是否 含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)。请评价该同学设计的鉴定方案是否合理?为什么?答:▲。
含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)。请评价该同学设计的鉴定方案是否合理?为什么?答:▲。
(4)为了进一步提纯1-溴丁烷,该小组同学查得相关有机物的有关数据如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| 1-丁醇 |
-89.5 |
117.3 |
1-溴 丁烷 丁烷 |
-112.4 |
101.6 |
| 丁醚 |
-95.3 |
142.4 |
| 1-丁烯 |
-185.3 |
-6.5 |
则用B装置完成此提纯实验时,实验中要迅速升高温度至▲收集所得馏分。
某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。A中发生反应的化学方程式:2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2H2O
CaCl2 + 2NH3↑+ 2H2O
(1)A中的反应(填“是”或“不是”)氧化还原反应;
(2)A装置还可用于制取气体(只填一种);
(3)实验室收集氨气的方法是;
(4)C、D装置中颜色会发生变化的是(填“C”或“D”);
(5)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是(填“F”或“G”);
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴人1-2滴浓盐酸,可观察到的现象是;
(7)2010 年 11月9日晚,我省一冷冻厂发生氨 气泄漏事件,500 多居民深夜大转移。假如你在现场,你会采用什么自救为法?。
气泄漏事件,500 多居民深夜大转移。假如你在现场,你会采用什么自救为法?。
实验室制取乙烯,常因温度过高而发生副反应。部分乙醇跟浓硫酸反应,生成炭黑、二氧化硫、二氧化碳和水蒸气。请用下图编号为①~⑥的实验装置,设计一个实验,以验证上述反应后的混合气体中含有二氧化硫、二氧化碳和水蒸气。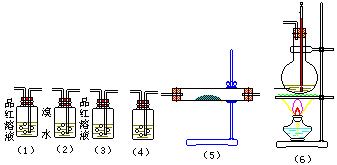
(1)装置⑤中的固体药品为,用以验证的产 物是。
物是。
(2)装置④中的溶液是,用以验证的产物是。
(3)装置①中的现象是 ;装置②中溴水的作用是。
;装置②中溴水的作用是。
(4)实验室制备乙烯的化学方程式:。