(9分)现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
请回答下列问题:
(1)写出下列物质的化学式:试剂X _______,沉淀A_______,沉淀B 。
(2)上述实验流程中加入过量的Na2CO3的目的是(用离子方程式表示) :
。
(3)按此实验方案得到的溶液3中肯定含有___________(填化学式,下同)杂质。为了除去该杂质,可以向溶液3中加入适量的___________ ,若要获得固体NaNO3需进行的实验操作是________________。
下列物质中:
(1)互为同分异构体的有;(2)互为同素异形体的有;
(3)互为同位素的有;(4)互为同系物的有___________。(填序号)
①石墨②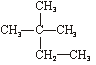 ③C60④CH4⑤
③C60④CH4⑤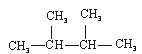 ⑥
⑥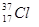 ⑦
⑦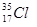 ⑧金刚石⑨C3H6⑩C4H10
⑧金刚石⑨C3H6⑩C4H10
下图是元素周期表中一部分
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)④、⑤、⑥的原子半径由大到小的顺序为(填元素符号)
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)
(3)①、④、⑤中的元素可形成既含离子键又含极性共价键的化合物,写出化合物的电子式为,由表中②、④两种元素的原子按1:2组成的化合物的结构式为_________________。
食物是人类赖以生存的物质基础,食物中能够被人体消化、吸收和利用的各种营养物质称为营养素。回答下列问题:
(1)人体需要的营养素主要有糖类、蛋白质、维生素、水、 和 。
(2)下列病患是由于缺乏维生素引起的是
A.夜盲症 B.佝偻病 C.坏血病
(3)往KMnO4溶液中滴入维生素C溶液,KMnO4溶液褪色说明维生素C具有 性。
(4)有关维生素C说法不正确的是
A.蔬菜应先洗后切 B.蔬菜应慢火慢煮
C.维生素C可使溴水褪色 D.维生素C可用食品添加剂
下表是某品牌食品包装袋上的说明
| 品名 |
肉松蛋卷 |
| 配料 |
小麦粉;②鸡蛋;③食用植物油;④白砂糖⑤肉松; ⑥食用盐; ⑦食用香料; ⑧β-胡萝卜素;⑨苯甲酸钠 |
| 生产日期 |
标于包装袋封口上 |
(1)配料中的着色剂是 (填序号)
(2)蛋白质是重要营养物质,处于生长发育期的青少年需要量很大。上述配料中,富含蛋白质的是
________。(填序号)
(3)食用植物油摄入人体后,在酶的作用下水解为高级脂肪酸和 (写名称),进而被氧化成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
(4)该食品配料中还缺少的营养素是 (填名称);为均衡营养,可在食用该“肉松蛋卷”时,最好配以下列食品中的 (填标号)
A.牛肉 B.菠菜 C.马铃薯(土豆)
.有甲、乙、丙三种物质: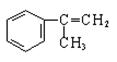
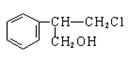

甲乙丙
(1)乙中含有的官能团的名称为____________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):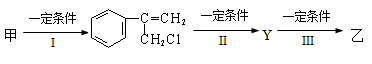
其中反应I的反应类型是_________,反应II的条件是_______________,反应III的化学方程式为__________________________________(不需注明反应条件)。
(3)由甲出发合成丙的路线之一如下: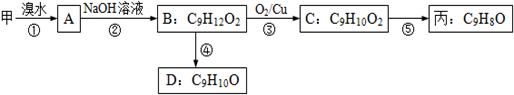
(a)下列物质不能与B反应的是(选填序号)。
a.金属钠 b.FeCl3c.碳酸钠溶液 d.HBr
(b)丙的结构简式为。
(c)任写一种能同时满足下列条件的D的同分异构体结构简式。
a.苯环上的一氯代物有两种
b.遇FeCl3溶液发生显色反应
c.能与Br2/CCl4发生加成反应