(14分) 下图是实验室常用的装置。请据图回答: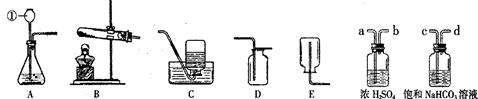
(1)写出仪器①的名称_____________。收集某气体采用E装置,可推测该气体具有的性质是________________________ 。
(2)实验室用加热高锰酸钾的方法制取氧气的发生装置是_____________(填选项),反应的化学方程式是___________________________。
(3)实验室制取二氧化碳的发生和收集装置是_______,(填选项)CO2气体中常含有的杂质是_______。为了得到纯净、干燥的气体,除杂装置的导管气流方向连接顺序是_____________(填选项)。
| A.a→b→c→d | B.b→a→c→d | C.c→d→a→b | D.d→c→b→a |
著名侯氏制碱法的重要反应之一:NH3 +CO2 +H2O+NaCl ="=" NaHCO3 +NH4Cl。在生产中,NaHCO3易结晶析出,经过滤得到NaHCO3晶体和滤液。某化学兴趣小组欲探究所得滤液中溶质的成分,及制得的纯碱样品中Na2CO3的质量分数,请你参与他们的探究活动。
【查阅资料】Ⅰ.碳酸钠和氯化钙能发生复分解反应。
Ⅱ.2NaHCO3△Na2CO3 +CO2↑+H2O; NH4Cl△NH3↑+HCl↑。
Ⅲ.NaCl溶液与AgNO3溶液反应产生不溶于稀HNO3的白色沉淀。
【探究实验1】滤液中含有的溶质是什么?
【作出猜想】猜想1:NH4Cl猜想2:NaHCO3猜想3:NaCl
猜想4:……
【交流与讨论】(1)化学兴趣小组认为溶质含有NaCl,理由是。
(2)化学兴趣小组经过讨论,认为猜想4可能是。
【实验推断】
| 实验步骤 |
实验现象 |
实验结论及分析 |
| ①取少量滤液于试管中,滴加足量的NaOH浓溶液后加热,并将湿润的红色石蕊试纸放在试管口。 |
滤液中含有NH4Cl,有关化学方程式: NaOH + NH4Cl =" NaCl" + NH3↑+ H2O |
|
| ②另取少量滤液于试管中,滴加稀盐酸。 |
产生无色 无味气体。 |
滤液中含有,有关化学方程式: 。 |
| ③另取少量滤液蒸干后充分灼烧,取灼烧后的残余固体溶于水,滴加稀HNO3,再滴加AgNO3溶液。 |
产生白色沉淀。 |
滤液中含有,滤液蒸干后充分灼烧的目的是。 |
【探究实验2】测定NaHCO3晶体受热后所得粉末中Na2CO3的质量分数。
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
| 实验操作 |
实验现象 |
实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液。 |
产生白色沉淀。 |
反应的化学方程式: 。 |
(2)分析滴加的CaCl2溶液要过量的原因:。
(3)应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量。利用沉淀物质量计算Na2CO3 的质量分数为96%。如果不洗涤沉淀物会造成测定结果大于96%,这是因为。
某小组同学利用如图所示装置探究铁生锈的条件,其中C、D的分液漏斗中为足量且浓度和体积均相同的稀盐酸。
(1)步骤一:关闭K2和K3,打开K1,A中反应的化学方程式是,B中所盛放的试剂是。对比铁丝表面的变化,能够说明铁生锈与水有关的是装置和(填C、D或E,下同),能够说明铁生锈的快慢与氧气浓度有关的是装置和。
(2)步骤二:关闭K1,打开K2和K3,将装置C、D中分液漏斗内的稀盐酸同时全部注入广口瓶中,两个广口瓶中现象的不同点是:①;②,由此也可以判断铁丝生锈情况。C中反应的化学方程式是。
(3)温度会影响铁生锈的快慢,请设计实验加以证明:。
初中化学常见白色固体甲由三种元素组成。将10g甲与100 mL水混合,得混合物A,再将A与足量稀盐酸反应得混合物B。
(1)若A中有白色沉淀,加入稀盐酸后沉淀溶解,且有气泡放出,则甲是。
(2)若A中有白色沉淀,加入稀盐酸后沉淀溶解,且无气泡放出,则甲是。
(3)若A为无色溶液,将其分成两等分,第一份加入稀盐酸后有气体放出,第二份加入(2)中的甲2g,有沉淀生成,此时所得溶液中的溶质是。第一份和第二份溶液中发生反应的化学方程式分别是、。
某工业生产上规定空气中二氧化硫的允许排放量不得超过0.02mg/m3。某研究性学习小组利用“碘量法”测定某化工厂附近空气中的二氧化硫的含量,请你参与并协助他们完成相关学习任务。
【查阅资料】淀粉遇碘(I2)变蓝,遇氢碘酸(HI)不变色。氢碘酸为无色液体。
【测定原理】
碘溶液吸收SO2的化学反应原理是:SO2 + I2 + 2H2O==X + 2HI。X的化学式为。
【测定步骤】
取配制好的碘(I2)溶液5.00mL(含I2的质量为6.35×10-4 mg)于下述装置中的反应容器内,并滴加2-3滴无色淀粉溶液。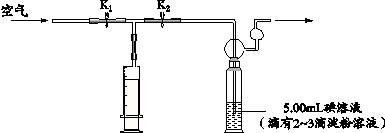
利用上述装置到指定的测试点抽气,每拉动1次注射器抽气100mL,并注入碘溶液中,直到反应恰好完全为止,记录抽气的次数。抽气时应进行的操作是。实验中表明恰好完全反应的现象
是
(3)换到不同地点再重复实验4次(每次所取碘溶液相同)。这样做的目的是。
每次实验的抽气次数记录 见下表。
| 实验次数 |
1 |
2 |
3 |
4 |
5 |
| 抽气次数 |
42 |
38 |
36 |
44 |
40 |
【得出结论】
| 二氧化硫的含量 |
是否超标 |
【交流与讨论】
实验结束后,有同学提议:可将插入碘溶液的导管下端改成具有多孔的球泡,有利于提高实验的准确度,其理由是。
(5分)实验室模拟炼铁原理进行实验,得到的尾气是CO、CO2的混合气体。现利用下图所示装置将混合气体进行分离,并得到干燥的气体。
(1)检查装置的气密性。A、B、C装置内放入一定量水,使长导管浸没在水面以下,关闭k2、k4,打开k1、k3,并在最右端导管口接注射器。当向外缓慢拉动注射器活塞时,若观察到,则说明整套装置气密性良好。
(2)装入药品。C中所盛试剂X为。
(3)分离两种气体。请完成下表(实验操作只需答出关闭和打开活塞即可)。
| 实验操作 |
分离出的气体 |
(4)在实验过程中,A中发生反应的化学方程式为。