根据下列事实,判断离子的氧化性顺序为①A + B2+ = A2+ + B ②D + 2H2O = D(OH)2+H2↑
③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2+ + 2e-= E,B - 2e- = B2+ ( )
A.E2+>B2+>A2+>D2+
B.D2+>A2+>B2+>E2+
C.D2+>E2+> B2+>A2+
D.A2+>B2+>D2+>E2+
设NA代表阿伏加德罗常数,下列说法正确的是
| A.常温常压下,2克氢气所含原子数目为NA |
| B.4.6克钠与水反应时失去的电子数目为0.2NA |
| C.在标准状况下,22.4LNH3所含的质子数目为NA |
| D.1 L0.5mol•L-1Na2SO4溶液中所含有的Na+离子数目为2NA |
下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是
| A.Na和O2 | B.FeCl3溶液和Mg |
| C.Fe和Cl2 | D.AlCl3溶液和NaOH |
下列实验中,能达到实验目的的是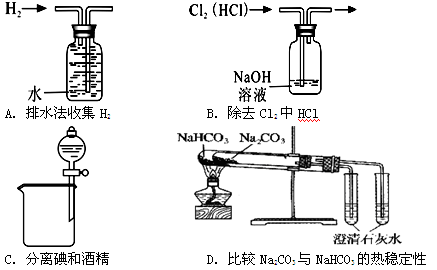
在无色透明溶液中,下列各离子组能大量共存的是
| A.SO42-Na+Fe3+ Cl- | B.Ba2+ Na+Cl- SO42- |
| C.HCO3-K+ SO42-OH- | D.Ag+ Al3+ NO3-H+ |
食盐、纯碱、食醋均为厨房中常用的物质,利用这些物质不能实现的实验是
①除去热水瓶内壁的水垢 ②检验自来水中是否含有氯离子
③检验镁粉中是否含有铝粉 ④鉴别食盐和纯碱
| A.①③ | B.②③ | C.②④ | D.①② |