SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案: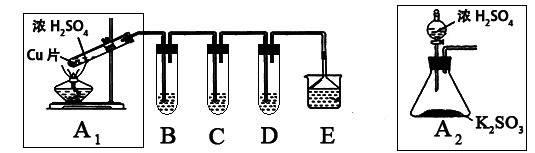
⑴ B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为______________,C中反应的离子方程式为:____________________________________________。
⑵为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:____________________________________________________(任写一点即可)。
⑶ E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 |
预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 |
若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体_______________ _______________________________________________________ |
_________________________ ____________________________ |
| 步骤3______________________________________________ ____________________________________________________ |
_________________________ _________________________ |
(8分)Ⅰ.(1)饱和氯化铵溶液显酸性,原因是
________________________________________________________________________
________________________________________________________________________;
向饱和氯化铵溶液中加入少量Mg(OH)2固体,固体完全溶解;其合理的解释(用相关离子方程式表示)为
________________________________________________________________________
________________________________________________________________________。
(2)向Mg(OH)2悬浊液中加入适量CH3COONH4溶液,
Mg(OH)2能否完全溶解________(填“能”或“否”),理由是
________________________________________________________________________
________________________________________________________________________。
Ⅱ.硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4===H++HSO4-,HSO4-===H++SO42-。
请回答下列有关问题:
(1)Na2SO4溶液呈________(填“弱酸性”“中性”或“弱碱性”),其理由是________________________________________________________________________
(用离子方程式表示);
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为
________________________________________________________________________
________________________________________________________________________。
(3)在0.10 mol·L-1的Na2SO4溶液中,下列离子浓度关系正确的是________(填写编号);
| A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4) |
| B.c(OH-)=c(HSO4-)+c(H+) |
| C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) |
| D.c(Na+)=2c(SO42-)+2c(HSO4-) |
(4)写出NaHSO4溶液中溶质电离常数(Ka)的表达式________________;
(5)若25℃时,0.10 mol·L-1的NaHSO4溶液中c(SO2-4)=0.029 mol·L-1,则0.10 mol·L-1的H2SO4溶液中c(SO42-)________0.029 mol·L-1(填“<”“>”或“=”),其理由是________________________________________________________________________;
(6)如果25℃时,0.10 mol·L-1H2SO4溶液的pH=
-lg 0.11,则0.10 mol·L-1的H2SO4溶液中c(SO42-)=________mol·L-1。
(8分)用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用________(填编号字母)作指示剂。
A.甲基橙 B.石蕊
C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视______________;在铁架台上垫一张白纸,其目的是________________________________________________________________________
________________________________________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol·L-1,烧碱样品的纯度是________。
| 滴定次数 |
待测溶液 体积(mL) |
标准酸体积 |
|
| 滴定前的刻度 (mL) |
滴定后的刻度 (mL) |
||
| 第一次 |
10.00 |
0.40 |
20.50 |
| 第二次 |
10.00 |
4.10 |
24.00 |
(5)下列实验操作会对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果________。
化学实验是研究物质性质的基础。
(1)下列有关实验操作或测量数据合理的是(填序号)。
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20mL的量筒,量取16.8mL的Na2CO3溶液
(2)某废水样品中含有一定的Na+、CO32-、SO32-,甲、乙两研究小组欲测定其中SO32-离子的浓度。
甲组方案:
试剂X从下列试剂中选择:
a.0.1mol·L-1KMnO4(H2SO4酸化)溶液b.0.5mol·L-1NaOH溶液c.新制氯水d.KI溶液
①加入的试剂X为(填字母序号),生成SO42-主要的离子方程式为。
②甲组方案中,第iii步的“系列操作”包含的操作名称各为。
乙组方案:
i.用烧杯盛取废水适量,加少量活性炭,除去废水的杂色;过滤,取滤液;
ii.精确量取20.00mL过滤后废水试样,选择使用紫色的0.1 mol·L-1KMnO4(H2SO4酸化)溶液进行滴定:(有关反应为:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O
iii.记录数据,计算。
③乙组设计的下列滴定方式中,最合理的是(夹持部分略去)(填字母序号)
(3)某同学制备Fe(OH)3胶体:用洁净烧杯量取适量蒸馏水加热至沸腾,向烧杯中缓慢滴加饱和的FeCl3溶液,并不断用玻璃棒搅拦,结果溶液变浑浊。该同学制备胶体失败的原因是,你认为成功制得Fe(OH)3胶体的特征现象是。
(4)用下图装置进行CO2性质的有关实验。
①试剂瓶B中盛有饱和NaHCO3溶液,其目的是。
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系。
某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4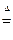 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。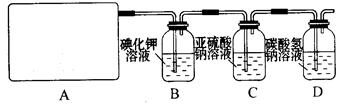
试回答:
(1)该实验中A部分的装置是(填写装置的序号)。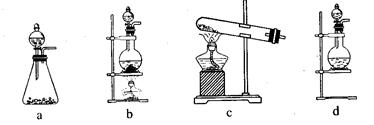
(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):
。
(3)写出D装置中发生反应的离子方程式。
(4)该实验存在明显的缺陷,请你提出改进的方法。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 ml 溶液,取25 ml 加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
反应完成时,共用去Na2S2O3 20.0 ml。则该漂白粉中Ca(ClO)2的质量分数为:
实验室要配制1mol/L的稀硫酸250mL,回答下列问题:
(1)需要98%密度为1.84g/cm3的浓硫酸mL
(2)配制时,必须使用的仪器有 (填代号)
①烧杯 ②100 mL量筒 ③20 mL量筒④1000 mL容量瓶⑤250 mL容量瓶 ⑥托盘天平(带砝码)⑦玻璃棒还缺少的仪器是 。
(3)配制时,该实验两次用到玻璃棒,其作用分别是、。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①没有洗涤烧杯和玻璃棒。 。
②如果加水超过了刻度线,取出水使液面恰好到刻度线。 。
③容量瓶没有干燥。