铁是日常生活中用途最广、用量最大的金属材料。
(1)常温下,可用铁质容器盛装浓硫酸的原因是 。
(2)某实验小组利用下图装置验证铁与水蒸气的反应。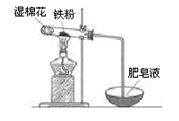
①湿棉花的作用是 ,试管中反应的化学方程式是 。
②实验结束后,取出少量反应后的固体于试管中,加入过量盐酸,
固体完全溶解,所得溶液中存在的阳离子是_____ (填序号)。
a.一定有Fe2+、H+和Fe3+ b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有 H+ d.一定有Fe3+、H+,可能有Fe2+
(3)另称取一定量的铁钉放入适量的浓硫酸中,加热,充分反应后收集气体。经测定气体中含有SO2、CO2和H2。
①铁与浓硫酸反应的化学方程式是 。
②气体中混有CO2的原因是(用化学方程式表示) 。
③将672 mL(标准状况)收集到的气体通入足量溴水中,反应的离子方程式为 ,然后加入足量BaCl2溶液,经洗涤、干燥得到固体4.66 g。由此推知收集到的气体中SO2的体积分数是 。
(1)写出甲烷发生一氯取代反应的化学方程式
(2)写出苯和浓硝酸、浓硫酸混合液在50 ~ 60℃时发生反应的化学方程式
如右图所示,在试管a中先加3mL乙醇,边摇动边缓缓加入2mL浓硫酸,摇匀冷却后,再加入2ml冰醋酸,充分搅动后,固定在铁架台上。在试管b中加入适量的A溶液。连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验。
(1)右图所示的装置中,装置错误之处是:;
(2)A是溶液;(3)加入浓硫酸的作用是:、;
(4)乙酸跟乙醇在浓硫酸存在并加热和条件下发生的酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(Ⅰ)这一步
如果将反应按加成、消去、取代反应分类,则A—F个反应中(将字母代号填入下列空格中),属于取代反应的是;属于加成反应的是;属于消去反应的是。
请写出下列物质的化学用语:
①葡萄糖的结构简式:
②乙醛与新制氢氧化铜溶液氢氧化钠存在下发生反应的化学方程式为:;
③溴乙烷和氢氧化钠的乙醇溶液共热的反应方程式为:
④石炭酸和足量的氢氧化钠溶液反应化学方程式:
某厂废水中含5.00×10-3mol·L-1的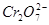 ,其毒性较大。某研究性学习小组为了变
,其毒性较大。某研究性学习小组为了变
废为宝,将废水处理得到磁性材料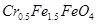 (
(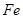 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:


 (1)第①步反应的离子方程式是,
(1)第①步反应的离子方程式是,
(2)第②步中用PH试纸测定溶液PH的操作方法是:
,
(3)第③步过滤得到的滤渣中主要成分除Cr(OH)3外,还有,
(4)欲使1L该废水中的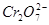 完全转化为
完全转化为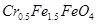 。理论上需要加入
。理论上需要加入
克FeSO4·7H2O。
在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸(以下填空分别用a、b、c表示)
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是。
(3) 将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是。
(5)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,则开始时反应速率的大小关系为。