氮可以形成多种离子,如N3-、NH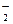 、N
、N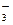 、NH
、NH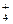 、N2H
、N2H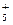 、N2H
、N2H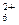 等,已知N2H
等,已知N2H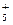 与N2H
与N2H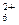 是由中性分子结合质子形成的,类似于NH
是由中性分子结合质子形成的,类似于NH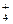 ,因此有类似于NH
,因此有类似于NH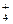 的性质。
的性质。
(1)NH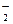 的电子式为__________。
的电子式为__________。
(2)N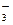 有__________个电子。
有__________个电子。
(3)写出两种由多个原子组成的含有与N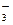 电子数相同的物质的化学式__________。
电子数相同的物质的化学式__________。
(4)等电子数的粒子往往具有相似的结构,试预测N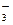 的构型____________________。
的构型____________________。
(5)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是__________。
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性, E是同周期元素中原子半径最小的元素。回答下列问题:
(1)五种元素中,原子半径最大的是,非金属性最强的是(填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是(用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为,其中存在的化学键类型为;
(4)D最高价氧化物的水化物的化学式为;
(5)单质E与水反应的离子方程式为。
(6)用电子式表示C和E形成化合物的过程。
(1)下图所示的原电池装置中,其负极材料是,正极上能够观察到的现象是,正极的电极反应式是。原电池工作一段时间后,若消耗锌6.5g,则放出气体__________g。
(2)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为PbO2+Pb+2H2SO4===2PbSO4+2H2O,据此判断:铅蓄电池的负极材料是________。工作时,电解质溶液的酸性________(填“增大”、“减小”或“不变”)。工作时,电解质溶液中阴离子移向_______极(填“正”或“负”)。电子流动方向为从_______极流向_______极(填“正”或“负”)。
(1)等质量的D216O和H216O所含的质子数之比为______,中子数之比为______;等物质的量的D216O和H216O分别与足量的金属钠反应,放出的氢气的质量比为_____,转移电子数之比为______。
(2)在2L密闭容器中进行如下反应:

 ,5min内NH3的质量增加了
,5min内NH3的质量增加了
1.7g,则v(NH3)=。
(10分)
(1) 已知:0.4 mol液态肼(N2H4)与足量的液态双氧水反应,生成氮气和水蒸气,放出256.65 kJ的热量.
①反应的热化学方程式为:____________________________________________.
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______________________________________________________________.
(2)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-a kJ/mol
途径Ⅱ:C3H8(g)===C3H6(g)+H2(g) ΔH=+b kJ/mol
2C3H6(g)+9O2(g)===6CO2(g)+6H2O(l)ΔH=-c kJ/mol
2H2(g)+O2(g)===2H2O(l)ΔH=-d kJ/mol
请回答下列问题:
①等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量________(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量.
②C3H8(g)===C3H6(g)+H2(g)的反应中,反应物具有的总能量________(填“大于”、“等于”或“小于”)生成物具有的总能量,.
③b与a、c、d的数学关系式是_____________________________________.
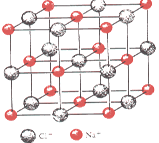
(12分)随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体细粒干燥后,准确称取m gNaCl固体细粒并转移到定容 仪器A中
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积V cm3。
(1)步骤①中仪器A最好使用(填序号)
| A.量筒 | B.烧杯 | C.容量瓶 | D.试管 |
(2)步骤②中是否用酸式滴定管还是用碱式滴定管,理由是
(3)能否用水代替苯,理由 是。
(4)已知NaCl晶体中,靠得最近的Na+、Cl—间的距离为a cm(如下图),则用上述方法测得的阿佛加德常数NA的表达式为NA=mol-1。