下表列出了核电荷数为21~25的元素的最高正化合价,回答下列问题:
| 元素名称 |
钪 |
钛 |
钒 |
铬 |
锰 |
| 元素符号 |
Sc |
Ti |
V |
Cr |
Mn |
| 核电荷数 |
21 |
22 |
23 |
24 |
25 |
| 最高正价 |
+3 |
+4 |
+5 |
+6 |
+7 |
(1)写出下列元素基态原子的核外电子排布式:
Sc____________________________ Ti_______________________________
V ____________________________ Mn ______________________________
(2)已知基态铬原子的电子排布是1s22s22p63s23p63d54s1,并不符合构造原理。人们常常会碰到客观事实与理论不相吻合的问题,当你遇到这样的问题时,你的态度是:___________________________________________________________。
(3)对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是__________________________________________________________;出现这一现象的原因是_________________________________________。
已知:A、B、C为中学常见的单质,A为淡黄色固体;D、E、F为中学常见的氧化物,E是具有磁性的黑色晶体;H、K为中学常见的盐;M为一种常见的无色液体。各物质间的转化关系如下图所示(某些条件已略去)。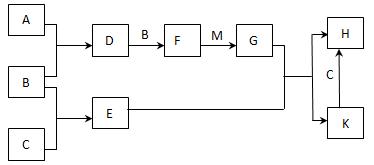
请回答:
(1)物质K的化学式为 。
(2)物质M的电子式为 。
(3)D可使酸性KMnO4溶液褪色,体现了D物质的 (填字母序号)。
A. 氧化性 B. 还原性 C. 漂白性
(4)C与M在一定条件下反应的化学方程式为 。
(5)先将D气体通入BaCl2溶液中,再通入NH3,实验过程中的现象为 。
(6)H溶液在空气中常期放置会出现红褐色浑浊,请用一个离子方程式表示其变化的原因: 。
(7)A与C可以在一定条件下发生化合反应,其产物中元素A与C的质量比为4:7,该物质是某矿石的主要成分之一,常用于生产G。某化工厂所用矿石样品含杂质25%,若取8.8吨该矿石,假设生产过程中无其他损失,可制得含G 98%的产品 吨。
22. 某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:
(1)混合物中是否存在FeCl2:____________(填“是”或“否”)。
(2)混合物中是否存在(NH4)2SO4:____________(填“是”或“否”)。
(3)写出反应⑤的离子方程式:________________________。
(4)请根据图中数据分析,原固体混合物的成分为(写化学式)
Na2CO3和H2O2结合成棒状晶体,Na2CO3·xH2O2(过氧化氢合相当于水合。注意:使用高浓度H2O2时一定要小心,防止爆炸生成水和氧气),可消毒、漂白或作O2源…。
现称取一定质量的Na2CO3·xH2O2晶体加热。实验结果以温度和相对质量分数示于下图。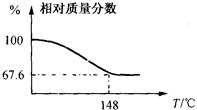
(1)该棒状晶体的化学式Na2CO3·xH2O2中x=。
(2)加热过程中,在141℃时表现为放热,其原因可能是:
a. Na2CO3·xH2O2分解放热
b.产生的H2O2分解放热
c. Na2CO3·xH2O2分解吸收热量小于产生的H2O2分解放出的热量
(3)事实上,Na2CO3·H2O2(x=1时)是Na2CO4·H2O(Na2CO4叫做过氧碳酸钠)。洗衣粉中加入适 量的Na2CO4可以提高洗涤质量,其目的是对衣物进行漂白、消毒。试用化学方程式表示上述洗涤原理:。
量的Na2CO4可以提高洗涤质量,其目的是对衣物进行漂白、消毒。试用化学方程式表示上述洗涤原理:。
(4)写出Na2CO4溶液与稀硫酸反应的离子方程式。
(5)下列物质不会使过碳酸钠失效的是
| A.MnO2 | B.H2S | C.CH3COOH | D.NaHCO3 |
(6) Na2O2、K2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢的水溶液可通过上述某种过氧化物与适量稀硫酸作用,最适合的过氧化物是,原因是。要使获得的过氧化氢从其水溶液中分离出来,采取的措施是 。
。
.下表是某食用碘盐包装袋上的部分说明:
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量 |
35±15mg/kg |
| 储藏方法 |
密封、避光、防潮 |
| 食用方法 |
烹饪时,待食品熟后加入碘盐 |
请回答下列问题:
(1)下列说法正确的是。
A.碘酸钾易挥发 B.高温会导致碘的损失
C.用淀粉就能直接检验碘盐中的碘酸钾 D.碘酸钾可氧化氯化钠
(2)碘酸钾与碘化钾在酸性条件下发生如下反应:KIO3+KI+H2SO4→K2SO4+I2+H2O(未配平),该化学方程式配平后系数依次为。
w.该反应的还原剂为;1mol KIO3完全反应转移的电子总数为。
(3)碘不能多也不能少。已知:I2+2S2O32-=2I-+S4O62-,我校化学兴趣小组测定某食用碘盐中碘的含量。其步骤为:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;③以淀粉为指示剂,逐滴加入物质的量浓度为1.0×11-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示)mg/kg。
A-H及X均为中学化学常见物质, X是一种金属单质,A、B是非金属单质且A在常温下为气体。它们在一定条件下有如下转化关系(图中条件均已略去)。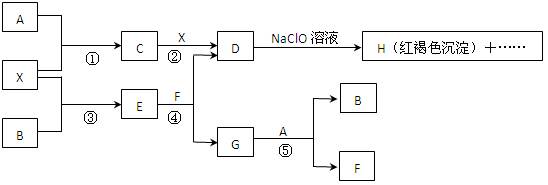
试回答下列问题:
(1)写出C物质的化学式 ;
(2)在上述①-⑤ 反应中肯定不属于氧化还原反应的是 (填编号);
反应中肯定不属于氧化还原反应的是 (填编号);
(3)指出元素X在元素周期表中的位置: ;
(4)请写出反应④和⑤的离子方程式:④ ,
⑤ ;
(5)用离子方程式表示在D溶液中加入NaClO溶液产生红褐色沉淀的原因:
。