如果要除去粗盐中含有的可溶性杂质氯化钙、氯化镁和一些硫酸盐,按下表所示顺序,应加入什么试剂?完成下列表格:
| 杂质 |
加入试剂 |
化学方程式 |
| 硫酸盐 |
|
|
| MgCl2 |
|
|
| CaCl2 |
|
|
某实验小组用MnO2与浓盐酸混合加热制取Cl2,并将制得的氯气与潮湿的Ca(OH)2固体反应制取少量漂白粉。实验装置如下图: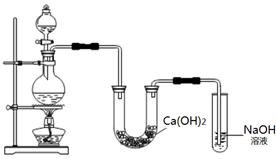
回答下列问题。
(1)漂白粉的有效成分是(写化学式)。
(2)烧瓶中发生反应的化学方程式是。
(3)温度较高时氯气与消石灰发生反应:6Cl2 + 6Ca(OH)2=5CaCl2 + Ca(ClO3)2 + 6H2O,该反应的氧化剂是,还原剂是,若反应消耗0.3mol Cl2,转移的电子数为mol。
(4)在中学化学中,常用作氧化剂的物质有、(写两种),常用作还原剂的物质有、
(写两种)。
氮的循环涉及到多种化学物质。(下图中的W、M、X、Y、Z均是化学物质)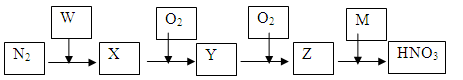
(1)由N2→X是工业合成氨的反应,写出其化学方程式。
(2)写出Y、M的化学式、。
(3)X可与HNO3反应,产物可用作氮肥,写出X与HNO3反应的化学方程式。
(4)某同学利用下图装置将氨气与氧化铜反应,验证氨气的性质并验证部分产物(部分未画出)
发现反应确实能发生,且反应后得到三种物质,其中有两种单质。
请回答下列问题:
① 实验室制取氨气的化学方程式是。
② 从氨中N元素的化合价角度看,该同学想证明的是氨的性质,实验中观察到的现象则能够证明氨具有这个性质。
③B装置的作用是。
④A中反应的化学方程式是。
(本题共11分)下图是制备二氧化硫制取和吸收装置(加热装置已省略)
分液漏斗中是液体反应试剂A,烧瓶中盛反应试剂B。完成下列填空:
32.实验室制备二氧化硫的试剂是和。
33.检验该气体发生装置气密性的方法是。
34.装置C是吸收多余二氧化硫的装置,其中盛放的吸收剂为,实验结束进行尾气吸收时,对活塞开关K1、K2的控制是。
35.如果用该套装置制备盐酸,此时C瓶所加试剂为,此时C中液体可能会发生倒吸,如果不改变现有的装置,要克服这一安全隐患,可以在C瓶中再加入有机试剂封住长导管管口,该有机试剂可以为___________,吸收后,将 C瓶中的液体经过操作获得盐酸。
36.甲同学用该装置测定一定质量小苏打样品(含少量NaCl)中碳酸氢钠的纯度,可以在C中加入氢氧化钠溶液吸收二氧化碳,通过C瓶增重得到二氧化碳质量,计算出碳酸氢钠的含量,实验结果小苏打含量偏低,你认为实验结果偏低的原因是。
(16分)根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)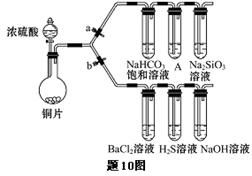
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸 >碳酸)
①连接仪器、、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是_______________,装置A中的试剂是。
③能说明碳的非金属性比硅强的实验现象是:_______________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①打开b,关闭a。能验证SO2具有氧化性的化学方程式是:。
②若大量的SO2通入NaOH溶液中,其化学方程式是:。
③BaCl2溶液中无沉淀现象,将其分成两份,分別滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 |
氯 水 |
氨 水 |
| 沉淀的化学式 |
写出其中SO2显示还原性并生成沉淀的离子方程式_______________________________。
I、实验室制备、收集干燥的SO2,所需仪器如下图。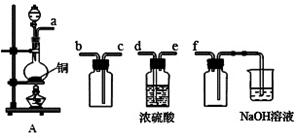
(1)装置A产生SO2,按气流方向连接各仪器接口,顺序为a→____→____→____→____→f。
(2)验证产生的气体是SO2的方法及实验现象是____。
II、SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示: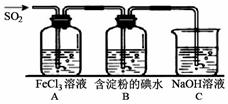
(1)装置A中的现象是_____。写出B中发生反应的离子方程式_____。
(2)若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤中没有用到的玻璃仪器有。
a.酒精灯
b.烧瓶
c.漏斗
d.烧杯
e.玻璃棒
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。上述方案中不合理的是_____。
(4)工业上通过煅烧黄铁矿产生SO2来进一步得到硫酸,已知煅烧1 g FeS2产生7.1 kJ热量,写出煅烧FeS2的热化学反应方程式_____。