(12分)某实验小组用0.50mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用470 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):
Ⅱ.测定中和热
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、盐酸、NaOH溶液,尚缺少的实验玻璃用品是 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
| 实验 次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
| 2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
| 4 |
26.4 |
26.2 |
26.3 |
30.4 |
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c="4.18" J/(g·℃)。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液进行中和热的测定.
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,则至少需要称量NaOH固体________g.
(2)从下图中选择称量NaOH固体所需要的仪器(填序号)________.
Ⅱ.测定中和热的实验装置如图所示
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol): ____________________________________________.
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如表.
①请填写表中的空白:
| 温度 实验 次数 |
起始温度t1/℃ |
终止温度t2/℃ |
平均温度差(t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
| 2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
| 4 |
26.4 |
26.2 |
26.3 |
30.4 |
|
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃).则中和热ΔH=________(取小数点后一位).
③上述实验结果的数值与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为_____________________________________________________;
(2)实验过程中,装置B、C中发生的现象分别是__________________、____________________,这些现象分别说明SO2具有的性质是________和________;装置B中发生反应的离子方程式为_______________________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象__________________________________________________________;
(4)尾气可采用________溶液吸收。
(Ⅰ)某无色溶液中可能含有Na+、SO42— 、MnO4—、 、Cl— 、Br—、中的若干种,依次进行下列实验。观察到现象如下:
、Cl— 、Br—、中的若干种,依次进行下列实验。观察到现象如下:
①用pH试纸检验,溶液pH>7;
②向溶液中滴加氯水,无气体产生,再加入CCl4振荡、静置,CCl4层呈橙红色,用分液漏斗分液;
③向分液后的水溶液中加入AgNO3和HNO3混合液,有白色沉淀产生。
④另取原溶液少量加入Ba(NO3)2和盐酸的混合液,产生白色沉淀。
回答下列问题:
(1)溶液中肯定含有的离子是;肯定没有的离子是。
⑵写出步骤②中的离子方程式。
(Ⅱ)SO2气体通入滴有酚酞的NaOH溶液,红色逐渐褪去,可能的原因:
①②。
简述设计实验证明:。
孔雀石的主要成分为Cu2(OH)2CO3还含少量二价铁和三价铁的氧化物及硅的氧化物。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图: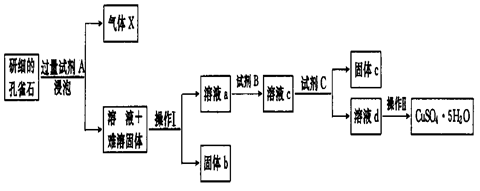
(1)试剂A的化学式是__________;操作I的名称是_________;操作Ⅱ用到的仪器有
酒精灯、玻璃棒、_________、坩埚钳和三角架。
(2)生成气体X的化学方程式为 。
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用_______(填选项序号)。
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
写出相应反应的离子方程式:。
(4)已知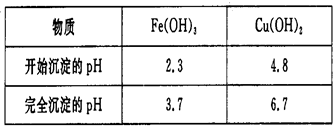
试剂C的使用是为了调节溶液的pH,使Fe3+转化为沉淀予以分离。试剂C宜选用 ___________(填选项序号);
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuO
为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为_________。
(5)请设计一种实验方案检验溶液中Fe3+是否完全除去(写出操作步骤、现象和结论)______。
无水CuSO4在一定条件下发生如下反应:
有人设计通过实验测定反应生成的SO3、SO2和O2,并经过计算确定该条件下分解反应方程式各物质的化学计量数,实验所需仪器装置如图所示。
实验测得数据及有关结果如下:
①准确称量无水CuSO46.0g。
②测出量筒中水的体积后,折算成排水的气体在标准状况下的体积为280ml。
③干燥管中的质量在实验结束时增加了3.2g。
④实验结束时,装置F中的溶液变成Na2SO4溶液(不含其他杂质)。
请回答如下问题:
已知气体从左向右的流向,上述仪器装置接口的连接顺序是a →ji→f e →c d →h g→ b
(1)装置F的作用是_____________,装置D的作用是_______________。
(2)首先应计算的物质是______________。
通过计算推断,该条件下反应的化学方程式是_____________________。
(3);(填序号)____________。