海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
已知:①海水中溴元素(以Br-表示)的浓度0.068g/L;
②Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。

(1)请写出一种海水淡化的方法:_____________。
(2)海水中溴离子的物质的量浓度为_____________ 。
(3)步骤Ⅰ中已获得低溶度的含Br2溶液,步骤Ⅱ中又将Br2还原为Br-,步骤Ⅲ又得到Br2,其目的为________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 。
(5)工业溴提纯可用蒸馏法,蒸馏时加热方法最好采用 ,蒸馏装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_________________________________。
目前世界上60%的镁是从海水中提取的。学生就这个课题展开了讨论的。已知海水提镁的主要步骤如下:
学生就这个课题提出了以下问题:
(一)在海水提镁的过程中如何实现对镁离子的富集?
有三个学生提出自己的观点。
学生甲的观点:直接往海水中加入沉淀剂。
学生乙的观点:高温加热蒸发海水后,再加入沉淀剂。
学生丙的观点:利用晒盐后的苦卤水,再加入沉淀剂。
请你评价三个学生提出的观点是否正确(填是或否),并简述理由。
| 是否正确 |
简述理由 |
|
| 学生甲的观点 |
||
| 学生乙的观点 |
||
| 学生丙的观点 |
(二)在海水提镁的过程中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,加入的足量试剂①是 (填化学式)。
(2)加入的足量试剂②是 (填化学式)。
(3)试从节约能源,提高金属镁的纯度分析,以下适宜的冶镁方法是。
A. |
B.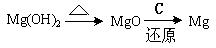 |
C.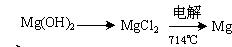 |
D. |
某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下:镁条、铝条、铝粉、钠、新制的Na2S溶液、新制的氯水、0.5mol/L的盐酸、3mol/L的盐酸、酚酞试液,其设计的实验方案及部分实验现象如下表:
| 实验步骤 |
实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 |
钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过,分别投入足量的相同体积的0.5mol/L的盐酸中 |
镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制的氯水滴加到新制的Na2S溶液中 |
|
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 |
剧烈反应产生气体,但铝粉消失比镁条快 |
请回答下列问题:
(1)实验③的现象是,该反应的离子方程式为,
(2)由实验③得出的实验结论是
(3)由实验②可得出决定化学反应快慢的主要因素是
(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确?(填是或否)
(5)通过实验④说明要加快化学反应速率可或。
某研究性学习小组为确定某纯净碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分)。[已知碱式碳酸镁Mgx(OH)y(CO3)z(x、y、z为正整数)加热能分解生成氧化镁、水和二氧化碳]
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是__________;A处U形管盛放的药品是__________________,其作用为_______________________。
(2)指导老师在审阅设计方案后指出需要在E处增加一装置,你认为该装置应该是_____________________________.
(3)加热前需要向该装置缓缓鼓入空气数分钟,其目的是___________________;此时对活塞的操作方法是:打开活塞____________________,关闭活塞_________________。
(4)关闭活塞K1、K2,打开K3,加热一段时间后,同学们发现C处洗气瓶中几乎没有气泡冒出,这是由于_________________________。
(5)反应完全后,打开K1,再缓缓鼓入空气数分钟,其目的是_____________________。
(6)实验测得数据如下:碱式碳酸镁样品22.6 g;反应前C装置的质量为87.6 g,反应后质量为89.4 g;反应前D装置的质量为74.7 g,反应后质量为83.5 g。请计算推导该碱式碳酸镁的化学式______________________,该碱式碳酸镁受热分解的化学方程式为____________。
(共18分)某化学兴趣小组在加热下利用二氧化锰与浓盐酸反应来制取并收集氯气。
(1)制取氯气时在烧瓶中加入一定量的二氧化锰,通过(填仪器名称)向烧瓶中加入适量的浓盐酸,写出该反应的化学方程式。
(2)这种装置制取得到的氯气中可能含有少量气体和气体,若要得到纯净干燥的氯气,应使气体依次通过装有和的洗气瓶。
(3)上述反应中,氧化剂是
(4)反应结束后还可能有少量的氯气,为了防止污染空气,必须把尾气通入中,写出反应的离子方程式
(5)该小组若用200mL 10mol·L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化挥发),则产生氯气的物质的量为0.5mol(填“大于”、“等于”或“小于”),原因是。
(6)87g二氧化锰与足量的浓盐酸反应,问生成的氯气在标况的体积为多少?参加反应的盐酸中被氧化的那部分的物质的量是多少?(相对原子质量:Mn—55 O—16 要求写出计算格式)
实验室用如图所示的装置制取乙酸乙酯.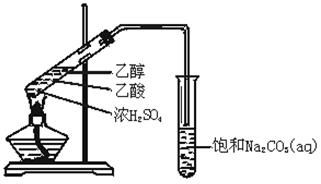
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是:,然后轻轻振荡试管,使之混合均匀。
(2)装置中通蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是防止Na2CO3溶液的倒吸.造成倒吸的操作上的原因是_______________________________。
(3)浓硫酸的作用是①___________; ②___________.
(4)饱和Na2CO3溶液的作用是_______________;_________________;
_____________________________。
(5)生成的乙酸乙酯的化学方程式,乙酸乙酯的密度比水________(填“大”或“小”),有_________味.
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是_____________(填物质名称).