在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 已知: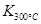 >
>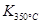 ,则该反应是 热反应。
,则该反应是 热反应。
(2)图中表示NO2的变化的曲线是 。用O2表示从0~2 s内该反应的平均速率v= 。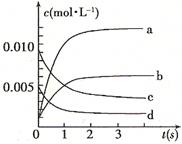
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(8分)2molCO2的质量为g,含分子数约为个,在标准状况下所占有的体积约为L,含氧原子的物质的量为mol。
(4分)小苏打是厨房里的常见物质,是发酵粉的主要成分,请 写出小苏打的化学
写出小苏打的化学
式,若食盐中可能混入了少量小苏打,用下列厨房中的进行检验。
A .白酒 B.食醋 C.酱油 D.白糖
.白酒 B.食醋 C.酱油 D.白糖
从环己烷可制备1,4环己二醇的二醋酸酯,下面是有关的化学反应过程(其中的无机物均已略去)。回答下列有关问题。
(1)反应②的类型是______________,反应⑧的类型是_____________。
(2)反应④的条件、试剂是
(3)写出B、C的结构简式:B________________; C_____________________
(4)写出反应②⑤的化学方程式_________________________________ _________________________________________________________。
在一定条件下,某些不饱和烃分子之间可以发生自身加成反应,如: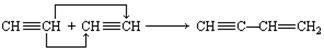
有机物甲的结构简式为: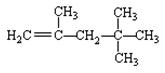 它是由不饱和烃乙的两
它是由不饱和烃乙的两
个分子在一定条件下自身加成而成得到的。在此反应中除生成甲外,还得到另一种产量更多的有机物丙,其最长碳链仍为5个碳原子,丙是甲的同分异构体。则乙和丙的结构简式分别为:
___________________________, ___________________________。
烷基取代苯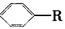 可以被KMnO4酸性溶液氧化生成
可以被KMnO4酸性溶液氧化生成 ,但若烷基R中直接与苯环连接的碳原子上没有C—H键,则不容易被
,但若烷基R中直接与苯环连接的碳原子上没有C—H键,则不容易被 氧化得到
氧化得到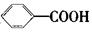 。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为
。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为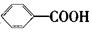 的同分异构体共有7种,其中的3种是:
的同分异构体共有7种,其中的3种是:
请写出其他的4种结构简式、、
、。