铝、铁两种金属的单质及其化合物在生产、生活中有着广泛的应用。请回答:
(1)两种金属与稀盐酸反应,除都生成氢气外,还分别生成的物质是
_ ___、__ __(填化学式)。
(2)将饱和氯化铁溶液滴入沸水中,得到Fe(OH)3 胶体。当光束通过下列物质时,能观察到丁
达尔效应的是__ __(填序号)。
①氯化铁溶液 ② Fe(OH)3 胶体
(3)向盛有氢氧化铝悬浊液的试管中滴加氢氧化钠溶液,得到无色透明溶液,该反应的离子方
程式为 。
按下图装置进行实验,并回答下列问题
(1)判断装置的名称:A池为___________ , B池为______________
(2)锌极为__________极,电极反应式为_______________ __________
(3)石墨棒C1为______极,电极反应式为__________ _____________
石墨棒C2附近发生的实验现象为________________ ______________
(4)当C2极析出224mL气体(标准状态)时,锌的质量减少_________g。
(4分 )常温下,有pH=12的NaOH溶液10ml,要使它的pH降为11,
)常温下,有pH=12的NaOH溶液10ml,要使它的pH降为11,
(1)若加入蒸馏水,则加入蒸馏水的体积为___________ ml。
(2)若加入pH=3的HCl溶液,则加入HCl溶液的体积为_________________ ml。
写出下列物质的电离方程式:
(1)NaHSO4溶于水_______________________________________________________
(2)H2S的电离________________________________________________________
现有七种元素,其中A、 B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息
B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息 ,回答问题。
,回答问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p 电子数比s电子数少1 电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1="738kJ/mol" I2 =" 1451" kJ/mol I3 =" 7733kJ/mol" I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式。
(2)B基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈 形。
形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为: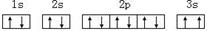
该同学所画的电子排布图违背了。
(4)G位于族区。
(5)DE3 中心原子的杂化方式为,用价层电子对互斥理论推测其空间构型为
中心原子的杂化方式为,用价层电子对互斥理论推测其空间构型为
(6)检验F元素的方法是,请用原子结构的知识解释产生此
现象的原因是
。
(7)F元素的晶胞如右图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为cm。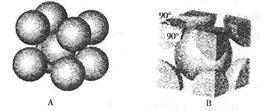
乙炔是有机合成工业的一种原料。工 业上曾用
业上曾用 与水反应生成乙炔。
与水反应生成乙炔。
(1) 中
中 与
与 互为等电子体,
互为等电子体, 的电子式可表示为;1mol
的电子式可表示为;1mol  中含有的
中含有的 键数目为_。
键数目为_。
(2)将乙炔通入 溶液生成
溶液生成 ,红棕色沉淀。
,红棕色沉淀。 基态核外电子排布式为。
基态核外电子排布式为。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为_。
(4) 晶体的晶胞结构与
晶体的晶胞结构与 晶体的相似(如右图所示),但
晶体的相似(如右图所示),但 晶体中含有的中哑铃形
晶体中含有的中哑铃形 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。 晶体中1个
晶体中1个 周围距离最近的
周围距离最近的 数目为_。
数目为_。