下列物质属于纯净物的是
| A.稀盐酸 | B.液氯 | C.空气 | D.氨水 |
下列叙述中正确的是
| A.Al、Fe、Cu三者对应的氧化物均为碱性氧化物 |
| B.Fe3+有氧化性,所以可以用FeCl3溶液来回收旧电路板中的铜 |
| C.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O===2Al(OH)3↓+CO32- |
| D.加入铝粉能产生H2的溶液中,一定存在大量的Na+、Ba2+、AlO2-、Cl- |
NA为阿伏加德罗常数,下列说法正确的是
| A.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
| B.标准状况下,22.4 L NH3中含有电子数为8NA |
| C.1 mol Cl2与足量Fe反应转移电子数为3NA |
| D.1 mol·L-1的AlCl3溶液中,Cl-的数目为3NA |
材料与化学密切相关。下列物质与材料对应关系不正确的是
| A.晶体硅——光导纤维 | B.氧化铝——耐火材料 |
| C.铁碳合金——碳素钢 | D.硅酸盐——普通玻璃 |
下列反应中,水作还原剂的是
| A.2Na+2H2O=2NaOH+H2↑ | B.Cl2+H2O=HCl+HClO |
| C.2F2+2H2O=4HF+O2 | D.SO2+H2O=H2SO3 |
下列离子在酸性溶液中能大量共存的是
A. |
B.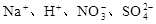 |
| C.Al3+、Fe2+、NO3-、Cl- | D.K+、Na+、Cl-、SiO32- |