今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol/L。如果在甲瓶中加入少量的NaHCO3晶体(n mol),在乙瓶中加入少量的NaHSO3晶体(n mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度的大小关系(溶液体积变化忽略不计)( )
| A.甲=乙>丙 | B.甲>丙>乙 | C.丙>甲=乙 | D.乙>丙>甲 |
下列说法正确的是
| A.吸热反应在常温下一定不能发生 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.已知C(石墨,s)=C(金刚石,s),△H1>0,说明石墨比金刚石稳定 |
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的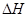 不同 不同 |
已知:2SO2(g)+O2(g)  2SO3(g)△H=—196.6kJ·mol—1,向密闭容器中加入2mol SO2(g)和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如下图所示,下列说法正确的是( )
2SO3(g)△H=—196.6kJ·mol—1,向密闭容器中加入2mol SO2(g)和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如下图所示,下列说法正确的是( )
注:t1~t2、t3~t4、t5之后各时间段表示达到平衡状态①、②、③。
| A.t2~t3时间段,平衡向逆反应方向移动 |
| B.平衡状态①和②,平衡常数K值相同 |
| C.平衡状态①和②,SO2转化率相同 |
| D.t4时刻改变的条件是减小压强 |
在容积均为500 mL的I、Ⅱ、Ⅲ三个密闭容器中分别充入l molN2和2.5 molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下发生反应N2(g)+3H2(g)  2NH3(g)H<O。实验测得反应均进行到t min时N2的体积分数如图所示。下列说法正确的是( )
2NH3(g)H<O。实验测得反应均进行到t min时N2的体积分数如图所示。下列说法正确的是( )
| A.当v(H2)=3v(N2)时,可以说明三个容器中的反应达平衡状态 |
| B.在t min时,一定达化学平衡状态的是Ⅱ和Ⅲ |
| C.在t min时,一定没有达化学平衡状态的是I |
| D.三个容器中的反应均达到平衡后,容器I中混合气体的平均相对分子质量最小 |
一定温度下,往a、b两容器中各注人1 mol三氧化硫,a、b两容器起始体积和压强均相同,分别保持恒容和恒压,发生以下反应: 2SO3(g) 2SO2(g)+O2(g),两容器中三氧化硫物质的量随时间(t)变化的示意图为( )
2SO2(g)+O2(g),两容器中三氧化硫物质的量随时间(t)变化的示意图为( )
可逆反应2A(g)+B(g) 2C(g),根据下表中的数据判断下列图像错误的是( )
2C(g),根据下表中的数据判断下列图像错误的是( )