我们目前使用得最多的燃料是煤、石油、天然气,它们都是由古代动植物遗体埋在地层下,并在地壳中经过一系列非常复杂的变化而逐渐形成的。因此,它们被称为化石燃料。这些燃料在地球上的蕴藏量是有限的,而且又都是经过亿万年才能形成的非再生能源,用一些就会少一些,最终会枯竭。如图是我国近年来能源总消费量与人均能源消费量。因此,如何来控制燃烧反应,使燃料充分燃烧,这对节约能源非常重要。如果我们能把煤等燃料利用率提高一倍,就相当于将这些燃料的使用时间延长一倍。当今世界各国能源研究的前沿课题之一就是如何提高燃烧效率,节约能源。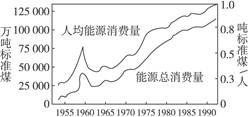
煤炭直接燃烧不仅产生大量烟尘,而且煤中所含的硫在燃烧时会生成SO2,这是导致酸雨形成的主要原因之一。因此,发展洁净煤技术、减少污染物的排放、提高煤炭利用率,正成为我国乃至国际上的又一项重要研究课题。
(1)使煤充分燃烧,提高煤的燃烧效率,应采取的措施是_____________________________。
(2)煤燃烧产生的主要污染物是_________,如果煤不充分燃烧还会产生的污染物有_________。
(3)高效、清洁地利用煤的主要途径有____________________________________。
(4)二十一世纪,人类在研究开发新能源方面一定会取得重大突破,你认为无污染的能源有____________________________________。
汽车作为一种常见交通工具,已走进千家万户。请回答下列问题: (1) 目前汽车使用的燃料是汽油。将石油加热,利用各成分的沸点不同将它们分离可得到汽油,该过程属于 变化。
(1) 目前汽车使用的燃料是汽油。将石油加热,利用各成分的沸点不同将它们分离可得到汽油,该过程属于 变化。 我国已推广使用车用乙醇汽油,它是在汽油中加入适量的乙醇,
我国已推广使用车用乙醇汽油,它是在汽油中加入适量的乙醇,
作为汽车的燃料。下列叙述正确的是 。
(填字母)
| A.乙醇汽油是一种新型的化合物 | B.乙醇可通过粮食发酵的方法制得 |
| C.使用乙醇汽油能减少有害气体的排放 | D.乙醇和汽油都是可再生能源 |
(2)汽车尾气(含有CO、NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个催化转换器,使CO和NO反应,生成两种无毒气体,试写出CO与NO反应的化学方程式 。
(3)汽车生产过程中需要各种金属,其中用量最大的是铁和铝。
①工业上炼铁的简要流程如下:
 |
请写出步骤Ⅰ、Ⅱ、Ⅲ的化学反应方式 、 、。
② 早在西汉时期,我国劳动人民就利用铁与硫酸铜溶液反应制取铜,称为“湿法炼铜”,即反应③,若用该方法制得铜16千克,理论上需要溶质质量分数为10%的硫酸铜溶液多少千克?(写计算过程)
(4分)某气体X可能是由H2、CO、CO2中的一种或两种组成,为了解其组成情况,某同学设计了如下装置进行实验 (假设各步反应均完全)
(1)请根据下表中对可能出现的实验现象的描述,推测气体X的组成情况,
| 可能出现的实验现象 |
气体X的组成 |
|||
| A中液体 |
B中黑色粉末 |
C中液体 |
||
| ① |
不浑浊 |
变成光亮的红色 |
不浑浊 |
H2 |
| ② |
不浑浊 |
变成光亮的红色 |
变浑浊 |
一定有CO, 可能有H2 |
| ③ |
变浑浊 |
变成光亮的红色 |
不浑浊 |
|
| ④ |
变浑浊 |
变成光亮的红色 |
变浑浊 |
|
(2)写出B中发生的化学方程式(任写一种) 。
(3)若b管口导出的气体中还含有部分CO气体,应采取的措施是 。
化学与生活密切相关,在厨房里蕴藏着许多化学知识。
(1)下列食物中,能提供大量维生素的是(填字母序号);
(2)厨房中的下列物品中,所使用的主要材料属于天然纤维的是(填字母序号
(3)我们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有的功能;
(4)厨房中能用来除去水壶中水垢的物质是(填“食醋”或“食盐水”)。
(5)防止厨房菜刀生锈,可采用的防锈措施有:(写出一种即可)。
(6)小明家厨房用的是天然气作为燃料,天然气在空气中完全燃烧的化学方程式为。
(4分)化学与我们的生活息息相关。现有:①氮气②生石灰 ③熟石灰 ④二氧化硫。回答下列问题(均填序号):
(1)可作干燥剂的是_______。(2)能形成酸雨的是_______。
(3)常用来改良酸性土壤的是_______。(4)充入灯泡可延长灯泡使用寿命的是_______。
实验室需配制4%的氢氧化钠溶液200g,并用此溶液测定某敞口放置一段时间的盐酸的溶质质量分数。
(1)配制200g质量分数为4%的氢氧化钠溶液,需要氢氧化钠固体的质量为g,水的体积为mL(水的密度近似看作1g/cm3)。 (2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
(2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
4%的氢氧化钠溶液,用pH计(一种测定溶液pH的仪器)
测定溶液的pH,得到的数据如下:
| 加入氢氧化钠 的体积/mL |
0 |
1.0 |
8.0 |
9.5 |
10.5 |
12.0 |
16.5 |
| 烧杯中溶液pH |
1.0 |
1.3 |
2.0 |
3.9 |
9.9 |
11.9 |
12.8 |
依据表中数据绘制出烧杯中溶液的pH与加入氢氧
化钠溶液体积(V)之间的变化关系图。
(3)根据上图查出氢氧化钠与盐酸恰好完全反应时,所滴加氢氧化钠溶液的体积为mL,A点所表示的溶液中溶质的化学式为。
(4)计算此瓶盐酸的溶质质量分数。(请写出计算过程。氢氧化钠溶液的密度按1.0g/mL计算)