工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0)
Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行该反应,下列叙述正确的是
| A.反应过程中,若增大压强因为反应速率增大,所以能提高SiCl4的转化率 |
B.已知,一定温度下,反应的平衡常数(k)为定值,若向已经达到平衡状态的容器中再次加入四种物质,若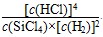 >k,平衡就要向正反应方向移动 >k,平衡就要向正反应方向移动 |
| C.反应至4 min时,若HCl的浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol/(L·min) |
| D.当反应吸收热量为0.025Q kJ时,生成的HCl可被100 mL 1 mol·L-1的NaOH溶液恰好完全吸收 |
下表为元素周期表前三周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
| A.常压下五种元素的单质中Z单质的沸点最高 |
| B.Y、Z、W的阴离子的还原性强弱顺序为:Z— >Y2—>W3— |
| C.最高价含氧酸的酸性强弱顺序为:H2YO4>HZO4>H3WO4 |
| D.五种元素对应的单质固态时均为分子晶体 |
工业生产中物质的循环利用有多种模式。例如: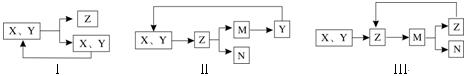

 下列表述不正确的是
下列表述不正确的是

























A.若图I为合成氨,则其中N2、H2可循环使用 |
B.若图I为合成SO3,则其中SO2、O2可循环使用 |
C.若图Ⅱ为电解熔融MgCl2得到镁,则其中HCl可循环使用 |
D.若图Ⅲ为氨氧化法制硝酸,则其中NO2可循环使用 |
在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况。下列反应中属于这种情况的是
①过量的锌与浓硫酸反应;②溶液中过量的I- 与少量的Fe3+反应;③过量的浓盐酸与碳酸钙反应;④过量的乙酸和少量乙醇在浓硫酸、加热条件下;⑤过量二氧化锰与浓盐酸在加热条件下;⑥过量的碳单质与浓硫酸在加热条件下
| A.②③④⑥ | B.②④⑤⑥ | C.①②④⑤ | D.④⑤⑥ |
青石棉(cricidolite)是世界卫生组织确认的一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,青石棉的化学式为:Na2Fe5Si8O22(OH)2,青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法中正确的是
| A.青石棉是一种易燃品,且易溶于水 |
| B.青石棉的化学组成用氧化物的形式可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O |
| C.1mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗8.5 L 2 mol/L HNO3溶液 |
| D.1mol Na2Fe5Si8O22(OH)2与足量氢氟酸作用,至少需消耗7 L 2 mol/L HF溶液 |
早在1807年化学家戴维用电解熔融氢氧化钠制得钠: 4NaOH(熔)  4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH
4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
| A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑ |
| B.盖·吕萨克法制钠原理是利用铁的还原性比钠强 |
| C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同 |
| D.目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阳极,铁为 |
阴极