Cl2是重要的化工原料。
(1)写出用Cl2制备漂白液的离子方程式______________________。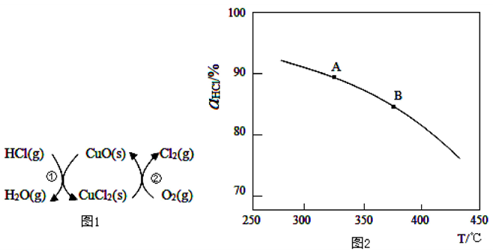
(2)图1所示的催化剂循环可实验用O2将HCl转化为Cl2,其中反应①为2HCl(g)+CuO(s)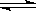 H2O(g)+CuCl2(s) ΔH1,反应②消耗1mol O2的反应热为△H2,则总反应生成1mol Cl2(g)的焓变为 (用ΔH1和ΔH2表示)。
H2O(g)+CuCl2(s) ΔH1,反应②消耗1mol O2的反应热为△H2,则总反应生成1mol Cl2(g)的焓变为 (用ΔH1和ΔH2表示)。
(3)实验室模拟用O2将HCl转化为Cl2的总反应
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的ɑHCl—T曲线如图2所示,则总反应的△H_________0 ,(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 ,简要说明理由: 。
②在上述实验中若压缩体积使压强增大,在图2中画出相应ɑHCl—T曲线的示意图。
③为提高HCl的平衡转化率下列措施中可行的是 。
A.增大n(HCl) B.增大n(O2) C.使用更好的催化剂 D.移去H2O
向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀的物质的量(n)和加入溶液B的体积(V)关系如图。
(1)当加入B溶液110mL时,溶液中的沉淀为(化学式)
(2)溶液B中Na2SO4与NaOH的物质的量浓度之比 ,从90 mL至100mL之间加入10 mL B溶液时发生的离子反应方程式
(3)将A、B溶液中各溶质的物质的量浓度填入下表
| 溶质 |
Na2SO4 |
BaCl2 |
FeCl3 |
| C(mol/L) |
I.向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:
(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为________>________>________;
(2)按顺序写出通入Cl2过程中发生反应的离子方程式为
__________________________________________;
__________________________________________;
__________________________________________。
(3)当溶液中n(Cl-)∶n(IO3-)=8∶1时,通入的Cl2在标准状况下的体积为________。
II.新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。生产K2FeO4的工艺流程如下图所示:
(1)写出“氧化”过程中生成Na2FeO4的化学方程式 。
(2)“转化”过程中发生的化学反应方程式为 。
工业合成氨与制备硝酸一般可连续生产,流程如图所示:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=" _____" (填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 ___ 573K(填“>”、“<”或“=”)。
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 ___ 573K(填“>”、“<”或“=”)。
| T/℃ |
T1 |
300 |
T2 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图所示。温度高于900℃时,NH3产率下降的原因是。
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2=(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(5)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为 。
常温下有浓度均为0.5mol・L-1的四种溶液:①碳酸钠溶液 ②碳酸氢钠溶液 ③盐酸 ④氨水。请根据题目要求回答下列问题:
(1)上述溶液中,可发生水解反应的是 (填序号,下同),在发生水解反应的溶液中pH最大的是 。
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是 。该物质水解的离子方程式为 。
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中 的值 (填“增大”或“减小”或“不变”)
的值 (填“增大”或“减小”或“不变”)
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)= 。