三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法不正确的是
| A.可用铁作阳极材料 |
| B.电解过程中阳极附近溶液的pH降低 |
| C.阳极反应方程式为:2Cl--2e-=Cl2 |
| D.1 mol二价镍全部转化为三价镍时,外电路中通过了1 mol电子 |
某全钒新型电池,以惰性材料作电极,在电解质溶液中发生电池总反应为:
下列说法正确的是
| A.当电池无法放电时,只要更换电解质溶液,不用外接电源进行充电就可正常工作 |
B.放电时,负极反应为 |
| C.充电时,阳极附近溶液由绿色逐渐变为紫色 |
| D.放电过程中,正极附近溶液的pH变小 |
下列说法正确的是
| A.将Ca(OH)2饱和溶液加热,溶液的pH增大 |
| B.常温下,pH=11的氨水与pH=3的盐酸等体积混合后,溶液的pH>7 |
| C.将0.1mol/L的HI溶液加水稀释l00倍,溶液中所有离子的浓度随之减小 |
| D.两种醋酸溶液的pH分别为a和(a+1),物质的量浓度分别为c1和c2,则有c1=10c2 |
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族且c比d少一个电子层。a的原子结构示意图如下左图,b与c形成化合物的电子式如下右图。下列比较中正确的是

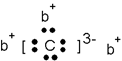
| A.原子半径b>a>d | B.单质的氧化性a>c>d |
| C.最高价氧化物的熔点a>d>b | D.最高价含氧酸的酸性d>c>a |
氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1 kJ,破坏1mol氯气中的化学键消耗的能量为Q2 kJ,形成1mol氯化氢中的化学键释放的能量为Q3 kJ。下列关系式中,正确的是
| A.Q1+ Q2 > Q3 | B. Q1+ Q2 > 2Q3 |
| C.Q1+ Q2 < 2Q3 | D. Q1+ Q2 < Q3 |
下列关于催化剂的说法,正确的是
| A.催化剂能使不起反应的物质发生反应 |
| B.催化剂能使某些化学反应程度改变 |
| C.催化剂能改变化学反应速率 |
| D.加入催化剂,一定会使反应加速 |