(11分)有一包白色固体粉末,其中可能含有KCl、BaCl2、Cu(NO3)2、K2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
试根据上述实验事实,回答下列问题:
(1)写出原白色粉末中一定含有的物质的化学式
(2)写出原白色粉末中一定不含有的物质的电离方程式
(3)写出下列各步变化的离子方程式:
②
④
在标准状况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在__________式滴定管内,若用甲基橙作指示剂,达到滴定终点时,溶液从_________色变为____________色;
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第_____________种(填序号);
①2.500 mol/L②0.25 mol/L③0.025mol/L
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用c(Na2CO 3)表示,滴定时实验数据列表如下:
| 实验编号 |
待测盐酸体积(mL) |
滴入Na2CO3溶液体积(mL) |
| 1 |
20.00 |
18.80 |
| 2 |
20.00 |
16. 95 |
| 3 |
20.00 |
17. 05 |
根据以上数据计算时应带入的Na2CO3溶液体积_______________求这种待测盐酸的物质的量浓度(用数据和符号列式即可):c(HCl)=_________________。
国际化学年的中国宣传口号是“化学-----我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”道理。请填空:
①若金属钠等活泼金属着火时,应该用 来灭火。
②经火焰灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)的元素是 。
③胃舒平(含有氢氧化铝)可治疗胃酸过多,其反应的离子反应方程式为: 。
④明矾能净水,其电离方程式是 。
用于分离或提纯物质的方法有:
A蒸馏(分馏) B萃取 C过滤 D重结晶 E分液。
下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)除去Ca(OH)2溶液中悬浮的CaCO3微粒 。
(2)分离四氯化碳与水的混合物 。
(3)分离汽油和煤油 。
(4)分离碘水中的碘单质 。
(5)提纯氯化钠和硝酸钾混合物中的硝酸钾 。
在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是 ;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 , (答两种);
(3)为了进一步研究上述反应中硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下6组实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实 验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol·L-1H2SO4 / mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液 / mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O / mL |
V7 |
V8 |
V9 |
15 |
10 |
0 |
请完成此实验设计,其中:其中:V2 V5(填“>”、“<”或“=”);
V5= , V6= ,V8= ;(填具体数值)
化学在能源开发与利用中起到十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图实验(图中所用电极均为惰性电极)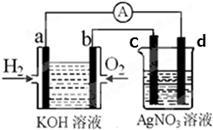
(1)电极a为 极(填“正”或“负”),溶液中OH-移向 极(填a或b);
(2)电极b处所发生的电极反应方程式为 ;[随着反应的进行,氢氧燃料电池内部溶液的PH将 (填“增大”或“减小”);
(3)c极为 (填“阴”或“阳”)极,d电极反应式为 ;
(4)右图装置中盛有100mL0.1mol·L-1AgNO3溶液,当装置工作时右装置中发生的总反应方程式为 ;
(5)当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时右图装置中溶液的c(H+)= 。(溶液体积变化忽略不计)
(6)氢氧燃料电池的优点 ;