将一块重12.9 g且表面已经氧化的铝片放入300 mL 3 mol/L的盐酸中,放出气体3.36 L(标况下),且固体恰好完全溶解。
(1)铝片中铝单质的物质的量是多少?
(2)如果向上述的溶液中加入1 mol/L的NaOH溶液200 mL,生成沉淀是多少克?
(3)如果向上述溶液中加加入1 mol/L的NaOH溶液1200 mL,是否有沉淀生成?如果有,是多少克?
将气体A、B置于容积为2L的密闭容器中,发生如下反应:3A(g) +B(g) 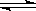 2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用生成物C的浓度增加来表示该反应的速率为:;
(2)用生成物A的浓度减少来表示该反应的速率为:;
(3)反应前A、B的物质的量浓度分别是:、。
(4)10s末,生成物D的浓度为。
在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g) 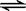 4NO2(g)+ O2(g)。
4NO2(g)+ O2(g)。
反应5min后,测得N2O5转化率为20%,求:
(1)υ(NO2)、υ(O2)分别为多少?
(2)5min时,N2O5占混合气体总体积的百分比是多少?
常温下,将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液13 ml和pH=3的某一元弱酸HA溶液20ml恰好完全反应生成NaA。试求:
(1)NaOH溶液的物质的量浓度
(2)此一元弱酸的物质的量浓度
(3)求此条件下该一元弱酸的电离平衡常数
向8 g二价金属的氧化物固体中加入稀H2SO4,使其恰好完全溶解,已知所消耗的硫酸体积为100 mL,在所得溶液中插入铂电极进行电解,通电一段时间后,在一个电极上收集到224 mL(标准状况)氧气,在另一个电极上析出该金属1.28 g。
(1)根据计算确定金属氧化物的名称。
(2)计算通电后硫酸溶液的物质的量浓度(假设溶液体积不变)。
(1)常温下100mL0.05 mol·L-1的氢氧化钡溶液中滴加硫酸钠溶液,当两者恰好完全反应时,测得溶液的pH为12。则加入硫酸钠溶液的体积是____________ ml。(溶液混合时体积的变化不计,下同)
(2)常温下,若100体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的PH(用a表示)与强碱的PH(用b表示)之间应满足的关系是。
(3)已知100℃ KW=1×10-12 ,0.1mol/LNaOH溶液,由水电离出的OH-物质的量的浓度为,PH=。