卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的价电子排布式为_______________。
(2)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。则Cl2、IBr、ICl的沸点由高到低的顺序为_____________。
(3)气态氟化氢中存在二聚分子(HF)2,这是由于___________________________。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为_____________________,中心原子杂化类型为________________。
(5)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为____________(填序号)。
(6)卤化物RbICl2在加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为______________________。
写出支链上共含有3个C原子,主链上含碳原子数最少的烯烃的结构简式。
下列各化合物中,属于同系物的是,属于同分异构体的是(填入编号)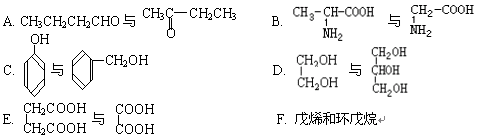
已知有机物A分子中有3个碳原子,有关它的某些信息注明在下面的示意图中: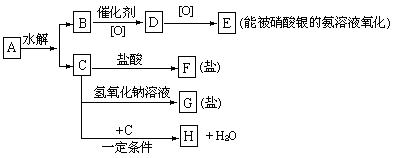
(1 )A、F、G的结构简式为:___________,____________,______________.
(2) 生成H的化学方程式为:__________________________________.
(10分)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W的气态氢化物化学式为,它的沸点比PH3的沸点,
(填“高”或“低”)W的气态氢化物稳定性比H2O(g)____ ____(填“强”或“弱”)。
(2)Y的基态原子核外电子排布式是______________,Y的第一电离能比X的________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
。
(4)已知下列数据:
Fe(s)+O2(g)===FeO(s) ΔH=-272.0 kJ·mol-1
2X(s)+O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是______________________________。
(共4分)在铜、银和硝酸银构成的原电池工作时,正极反应式为___________;当有1.6 g铜溶解时,银棒增重_________________。(相对原子质量:CU~64, Ag~108)