现有m g某气体,它由双原子分子构成,它的摩尔质量为M g · mol-1。若阿伏加德罗常数用NA表示,则:
· mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________;
(2)该气体所含原子总数为____________个;
(3)该气体在标准状况下的体积为_____________;
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为_________。
(1)下列4组物质均有一种物质的类别与其它三种不同
A.CaO、Na2O、CO2、CuOB.H2、C、P、Cu
C.O2、Fe、Cu、ZnD.HCl、H2O、H2SO4、HNO3
以上四组物质中类别不同的物质依次是(填化学式)(各1分)
A ______;B __;C;D 。
(2)写出下列物质在水溶液中的电离方程式:(各1分)
①氨水_________________________________________________________
②硫酸_________________________________________________________
③氢氧化钡_____________________________________________________
④硫酸铁_______________________________________________________
(3)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。(各2分)
A组:。B组:。
糖类、蛋白质是基本的营养物质,在我们的生活中扮演着及其重要的角色。如何正确识别这些物质的真伪,既检验同学们将化学知识应用于社会生活实际的能力,又可以减少伪劣物品对我们生活质量产生的负面影响。请选择下列鉴别试剂或鉴别方法:
| A.新制氢氧化铜 | B.碘水 | C.浓硝酸 | D.银氨溶液 E、燃烧 |
以及实验现象:① 烧焦羽毛味; ② 蓝色;③ 银镜(析出银);④黄色;
⑤ 砖红色沉淀用相应的序号填写下表:
葡萄糖是人体内最重要的供能物质,粮食中的糖类在人体中能转化成葡萄糖而被吸收。一部分葡萄糖在体内被氧化分解,最终生成二氧化碳和液态水,同时释放出能量,写出葡萄糖在体内氧化的化学方程式
油脂是一种重要的营养物质,在人体内水解生成高级脂肪酸和甘油(丙三醇),油脂的结构可表示为:__________________________________________。
芳香族化合物A有如下图的转化关系: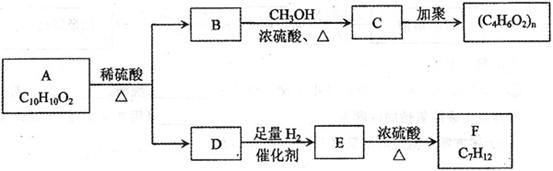
已知D能与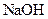 溶液反应,E转化为F时,产物只有一种结构,且能使溴的四氯化碳溶液褪色。请回答下列问题:
溶液反应,E转化为F时,产物只有一种结构,且能使溴的四氯化碳溶液褪色。请回答下列问题:
(1)B的分子式是_____________
(2)A、F的结构简式 A ___________ F __________
(3)写出B→C、E→F的化学反应方程式,并注明反应类型
B→C:_____________________________________________()
E→F:_____________________________________________()
(4)符合下列3个条件的A的同分异构体有多种
①苯环含有对二取代结构②遇 溶液不变色
溶液不变色
③能发生银镜反应
请写出其中任意一种的结构简式________________________________________