把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如右图所示
图中t1~t2速率变化的主要原因是 ________,t2~t3速率变化的主要原因是 。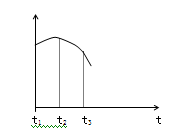
已知A元素原子核外电子排三层,其原子最外层比次外层少一个电子。甲、乙、丙、丁4种物质均含A元素,其中甲的焰色反应呈黄色,乙为气体单质,它们之间有如右图所示的转化关系(转化过程中部分产物未标出)。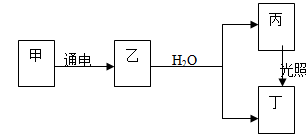
请回答下列问题:
(1)A元素的阴离子的结构示意图为;丙的化学式为
(2)写出甲溶液通电生成乙的化学方程式
(1)9.03×1023个CO2的物质的量是,在标准状况下的体积为L,质量是克。
(2)在100mL 2mol/L H2SO4溶液中,H2SO4的物质的量是__,H2SO4的质量是__ ___。H+的物质的量浓度为___ _____。
现由以下几种物质:①、Ba(OH)2固体②、NH4NO3晶体③、酒精④、氢氧化铁胶体⑤、 C⑥、Na2O固体⑦、T2O (其中1和2问用序号回答)
C⑥、Na2O固体⑦、T2O (其中1和2问用序号回答)
(1)以上物质中属于混合物的是____;属于盐的是;属于碱性氧化物的是
(2)以上物质中属于非电解质的是;表示一种核素的是;具有丁达尔效应的物质是
(3) Ba(OH)2的电离方程式
(4) NH4NO3的电离方程式
铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题:
(1)、放电时:正极的电极反应式是________________;正极区PH值将________(填“变大”“变小”“不变”);电解液中H2SO4的浓度将变________;当外电路通过1mol电子时,理论上负极板的质量增加________g。
(2)、在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成________,B电极上生成________,此时铅蓄电池的正负极的极性将________。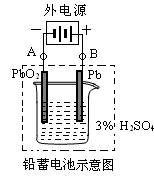
(3)、某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
Cu+H2SO4(稀)=CuSO4+H2↑。
请在方框中画出能够实现这一反应的装置图。
-
( 10分)A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六各物质中均含同一种元素,F是红褐色固体。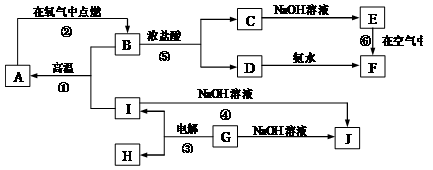
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素是。
(2)写出下列反应的化学方程式或离子方程式:
反应①的化学方程式:;
反应④的离子方程式:;
反应⑥的化学方程式:;
(3)从能量变化的角度看,反应①②③中,属于△H<0的反应是(填序号)。