常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是________________________
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
写出该混合溶液中下列算式的精确结果(不用做近似计算)。
c(Na+)-c(A-)=________mol·L-1 c(OH-)-c(HA)=________mol·L-1
(5)现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生;②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应;③把A、C用导线连接后同时浸入稀硫酸溶液中,电子流动方向为A→导线→C。根绝上述情况,回答下列问题:
(1)在①中,金属片发生氧化反应
(2)在②中,金属片作负极
(3)如果把B、D用导线连接后同时浸入稀硫酸溶液,则金属片上有气泡产生
(4)上述四种金属的活动顺序是
(14)已知元素X、Y、Z、W的原子序数分别为6、8、11、13,请回答:
(1)写出下列元素符号XYZW
(2)写出下列元素在周期表中的位置XY
ZW
(3)写出下列反应方程式:X+Y
Z+YW+Y
从
| A.乙醇; | B.乙酸; | C.甲烷; | D.苯四种种物质中选择合适的答案填在空格内(用字母填): |
(1)分子具有正四面体结构的是_________;
(2)跟碳酸氢钠溶液反应有二氧化碳生成的是___________;
(3)能作为燃料使用,属于可再生能源的是____________:
(4)分子中所有原子均共面的是_________________________.。
下列3种不同粒子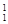 H、
H、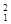 H、
H、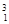 H表示______种元素,______种核素,
H表示______种元素,______种核素,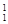 H、
H、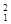 H、
H、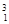 H互称为__________________。
H互称为__________________。
香豆素是一种用途广泛的香料,可用于配制香精及制造日用化妆品和香皂等。以下是某同学设计的香豆素的合成线路: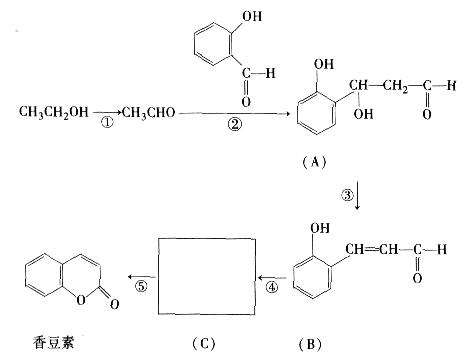
请你认真观察分析后回答以下问题:
(1)香豆素的分子式是:。
(2)写出中间产物C的结构简式,1mol C与溴水反应最多消耗mol Br2。
(3)B的同分异构体中,属于芳香族化合物且能够发生水解和银镜反应,其结构简式可能有种,写出其中任意一种的结构简式。