⑴有一学生在实验室测某溶液pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
①这种错误操作 (填“一定”/“一定不”/“不一定”)会导致实验结果有误差。
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 。
⑵、用已知浓度的 NaOH 溶液测定某 HCl溶液的浓度,参考右图,从表中选出正确序号 _____________
| 序号 |
锥形瓶中溶液 |
滴定管中溶液 |
选用指示剂 |
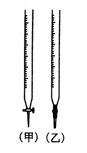 选用滴定管 选用滴定管 |
| A |
碱 |
酸 |
石芯 |
(乙) |
| B |
酸 |
碱 |
酚酞 |
(甲) |
| C |
碱 |
酸 |
甲基橙 |
(甲) |
| D |
酸 |
碱 |
酚酞 |
(乙) |
⑶、用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
⑷、已知滴定管中装有浓度为0.112mol/L的盐酸。逐滴加入到装有氢氧化钠的溶液的锥形瓶中。开始时读数及恰好反应时盐酸的读数见下表。
| 实验 编号 |
待测氢氧化钠溶液体积(mL) |
滴定开始读数(mL) |
滴定结束读数(mL) |
消耗盐酸体积(mL) |
| ① |
25.00 |
0.02 |
26.40 |
|
| ② |
25.00 |
0.04 |
25.81 |
|
| ③ |
25.00 |
0.03 |
25.78 |
|
| ④ |
25.00 |
0.20 |
25.96 |
|
试计算待测的氢氧化钠的物质的量浓度= .
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验 编号 |
实验目的 |
T/K |
pH |
c/10-3mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验作参照 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
||||
| ③ |
298 |
10 |
6.0 |
0.30 |
[数据处理]实验测得p—CP的浓度随时间变化的关系如图,①②③分别代表以上三组实验测得的数据曲线。
(2)请根据实验①曲线,计算降解反应在50~150s内的平均反应速率;v(p—CP)= mol·L-1·s-1。
(3)实验①、②表明温度升高,该降解反应速率_____。 (增大或减小)但其他文献表明,温度过高时(如接近100℃)反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_________________________。
(4)实验③得出的结论是:pH等于10时, __
(5)实验时需在不同时间从反应器中取样,并使所取样品中反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
(22分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式(有机物用结构简式表示):
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的顺序是:先在试管中加入一定量的 ,然后边加边振荡试管将 加入试管,冷却后再加入 。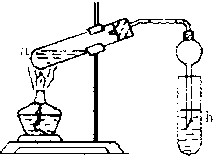
(3)浓硫酸的作用是:①;② 。
(4)饱和碳酸钠溶液的主要作用是。
(5)在实验中球形干燥管除起冷凝作用外,另一个重要作用是 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作叫 。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的 。
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化。
实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题: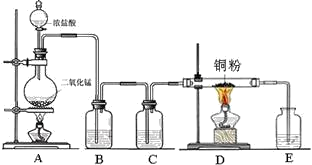
(1)写出烧瓶中发生反应的化学方程式,。
(2)B处盛有饱和食盐水(或水),其作用是。
(3)C处盛放的试剂__________(填名称),其作用是。
(4)E处盛有___________(填名称),发生反应的离子方程式为_________。
(5)实验结束时,应先熄灭__________处酒精灯。
(本小题满分7分)某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究。回答下列问题: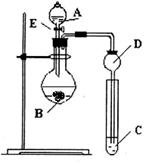
(1)图中D装置名称是。
(2) N、C、Si的非金属性由强到弱的顺序是:;
从以下所给物质中选出甲同学设计的实验所用到物质:
试剂A为_________;试剂C为_________(填序号)。
①稀HNO3溶液②稀盐酸③碳酸钙④Na2SiO3溶液⑤SiO2
(3) 乙同学设计的实验所用到试剂A为________;试剂B为________;试剂C为________。
(14分)某研究性学习小组将一定浓度的Na2 CO3 溶液滴入CuSO4 溶液中得到蓝色沉淀。甲同学认为两者反应只生成一种沉淀CuCO3 ;乙同学认为两者相互促进水解,只生成一种沉淀Cu(OH)2 ;丙同学认为生成CuCO3 和Cu(OH)2两种沉淀。[查阅资料知:CuCO3 和Cu(OH)2 均不带结晶水]
Ⅰ.按照乙同学的理解,Na2 CO3 溶液和CuSO4 溶液反应的化学方程式为。
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作①过滤、②洗涤、③干燥。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
(1)各装置连接顺序为。
(2)装置C中所装试剂的名称是。
(3)能证明生成物中有CuCO3 的实验现象是。
Ⅲ.若CuCO3 和Cu(OH)2两者都有,可通过下列所示装置进行定量分析来测定其组成。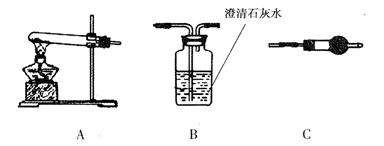
(1)装置C中碱石灰的作用是,实验开始和实验结束时都要通入过量的空气,其实验结束时通入空气的作用是。
(2)若沉淀样品的质量为m g,装置B的质量增加了n g,则沉淀中CuCO3的质量分数为。