(10分)已知X、Y、Z是阳离子,K是阴离子,M、N是分子。它们都由短周期元素组成,且具有以下结构特征和性质:
①它们的核外电子总数都相同;
②N溶于M中,滴入酚酞,溶液变红;
③Y和K都由A.B两元素组成,Y核内质子数比K多2个;
④X和N都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热条件下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量含K的溶液,有白色沉淀生成,再加入过量的含K或Y的溶液,沉淀消失。
回答下列问题:
(1)Y的化学式为 ;N的电子式为
(2)试比较M和N的稳定性:M (填“>”或“<”)N。
(3)写出Z和N的水溶液反应的离子方程式: ;
(4))上述六种微粒中的两种可与硫酸根形成一种含三种离子的盐,向该盐的浓溶液中逐滴加入0.1 的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
①写出b阶段的离子方程式:
②根据图像判断该盐的化学式为 。
(14分)CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为________。
②用CO、O2和固体电解质还可以制成如图1所示的燃料电池,则电极d的电极反应式为________。
(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。
①在图示的转化中,化合价不变的元素是________(填元素名称)。
②在转化过程中通入氧气发生反应后,溶液的pH将________(填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________。
③加入NaClO时发生的反应为:Cu(NH3) +2ClO-+2OH-===Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
+2ClO-+2OH-===Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有________、________。
(3)CO与SO2在铝矾土作催化剂、773 K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式:________________。
【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药。
(1)Ni2+基态核外电子排布式为。
(2)ClO4-的空间构型是;与ClO4-互为等电子体的一种分子为(填化学式)。
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为;1molCO(N2H3)2分子中含有σ键数目为。
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为a,Ni2+的配位数为b,NiO晶体中每个镍离子距离最近的镍离子数目为c,则a∶b∶c=。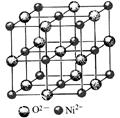
黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源。
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题20图-1所示:
① a反应中每生成1molFeSO4转移电子的物质的量为 mol。
② d反应的离子方程式为 。
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题20图-2
①冶炼过程中,正极周围溶液的pH (选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为 。
|
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题20图-3。
| 相关反应 |
反应热 |
平衡常数K |
FeS2(s) + H2(g)  FeS(s) + H2S(g) FeS(s) + H2S(g) |
ΔH1 |
K1 |
1/2 FeS2(s) + H2(g) 1/2Fe(s)+H2S(g) 1/2Fe(s)+H2S(g) |
ΔH2 |
K2 |
FeS(s) + H2(g) Fe(s)+H2S(g) Fe(s)+H2S(g) |
ΔH3 |
K3 |

①上述反应中,ΔH1 0(选填:“>”或“<”)。
②提高硫的脱除率可采取的措施有 (举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为 。
(12分)【选做题】本题包括A、B两小题,请选定其中一小题作答。若多做,则按A小题评分。
A.【物质结构与性质】
氧化锌(ZnO)、氮化镓(GaN)及新型多相催化剂组成的纳米材料能利用可见光分解水,生成氢气和氧气。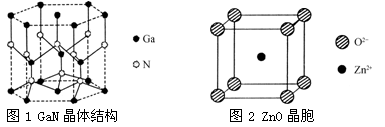
(1)Zn2+基态核外电子排布式为________。
(2)与水分子互为等电子体的一种阴离子是________(填化学式)。
(3)氮化镓(GaN)的晶体结构如图1所示,其中氮原子的杂化轨道类型是________;N、Ga原子之间存在配位键,该配位键中提供电子对的原子是________。
(4)ZnO是两性氧化物,能跟强碱溶液反应生成[Zn(OH)4]2-。 不考虑空间构型,[Zn(OH)4]2-的结构可用示意图表示为________。
(5)某种ZnO晶体的晶胞如图2所示,与O2-距离最近的Zn2+有________个。
(14分)以硫铁矿(主要成分为FeS2)为原料制取硫酸,其烧渣可用来炼铁。
(1)煅烧硫铁矿时发生反应:FeS2+O2―→Fe2O3+SO2(未配平)。当产生448 L(标准状况)SO2时,消耗O2的物质的量为________。
(2)Fe2O3用CO还原焙烧的过程中,反应物、生成物和温度之间的关系如图所示。
(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
已知:ⅰ.3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);ΔH1=a kJ·mol-1
ⅱ.Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);ΔH2=b kJ·mol-1
ⅲ.FeO(s)+CO(g)===Fe(s)+CO2(g);ΔH3=c kJ·mol-1
①反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH=________kJ·mol-1(用含a、b、c的代数式表示)。
②800 ℃时,混合气体中CO2体积分数为40%时,Fe2O3用CO还原焙烧反应的化学方程式为____________。
③据图分析,下列说法正确的是________(填字母)。
a.温度低于570 ℃时,Fe2O3还原焙烧的产物中不含FeO
b.温度越高,Fe2O3还原焙烧得到的固体物质组成中Fe元素的质量分数越高
c.Fe2O3还原焙烧过程中及时除去CO2有利于提高Fe的产率
(3)FeS2是Li/FeS2电池(示意图如图)的正极活性物质。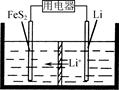
①FeSO4、Na2S2O3、S及H2O在200 ℃时以等物质的量连续反应24 h后得到FeS2。写出该反应的离子方程式:______________。
②Li/FeS2电池的负极是金属Li,电解液是含锂盐的有机溶液。电池放电反应为FeS2+4Li===Fe+4Li++2S2-。该反应可认为分两步进行:第1步,FeS2+2Li===2Li++FeS22-,则第2步正极的电极反应式为____________________。