常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如下图。下列说法正确的是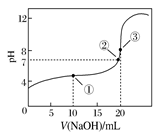
| A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
| B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) |
| C.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| D.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池在充、放电时:Cd+2NiO(OH)+2H2O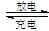 Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是:
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是:
| A.放电时的正极反应:NiO(OH)+H2O+e-=Ni(OH)2+OH- |
B.充电过程是化学能转化为 电能的过程,此电池可能是酸性电 电能的过程,此电池可能是酸性电 池 池 |
| C.放电时负极附近溶液的pH不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
将0.4mol丁烷完全燃烧后生成的气体全部缓慢通入1L 2mol/LNaOH溶液中,生成的 Na2CO3和NaHCO3的物质的量之比为:
| A.3:2 | B.2:3 | C.2:1 | D.1:3 |
反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2 2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定。
2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定。
| c(H2)/(mol·L-1) |
c(Cl2)/(mol·L-1) |
v/(mol·L-1 ·s-1) ·s-1) |
| 1.0 |
1.0 |
1.0 k |
| 2.0 |
1.0 |
2.0 k |
| 2.0 |
4.0 |
4.0 k |
由此可推得,m、n值正确的是:
| A.m=1,n=1 | B.m=1/2,n=1/2 | C.m=1/2,n=1 | D.m=1,n=1/2 |
在2L的密闭容器中进行如下反应:X2(g)+2Y2(g) 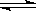 2Z(g),已知X2、Y2、Z的起始浓度分别为0.2mol/L、0.2mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是:
2Z(g),已知X2、Y2、Z的起始浓度分别为0.2mol/L、0.2mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是:
| A.Z为0.3mol/L | B.Y2为0.4mol/L | C.X2为0.1mol/L | D.Z为0.4mol/L |
根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W;Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为:
| A.X > Z > Y > W | B.Z > W > X > Y | C.Z > Y > X > W | D.Z > X > Y > W |