在下列化学方程式中,能够用离子方程式Ba2++SO42-=BaSO4↓表示的是( )
| A.BaCl2+K2SO4=BaSO4↓+2KCl |
| B.BaCO3+H2SO4=BaSO4↓+CO2↑+H2O |
| C.Ba(OH)2+ H2SO4=BaSO4↓+2H2O |
| D.Ba(OH)2+ 2KHSO4=BaSO4↓+K2SO4+2H2O |
滴有酚酞和氯化钠试液滤纸分别做甲、乙两个实验,能发现附近变成红色的电极是
| A.ac | B.bd | C.ad | D.bc |
可逆反应N2+3H2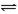 2NH3是一个放热反应。甲、乙是完全相同的容器,甲容器中加入1molN2和3 molH2,一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 molNH3,达平衡时,吸收的热量为Q2。已知Q2=4Q1,则甲容器中,H2的转化率
2NH3是一个放热反应。甲、乙是完全相同的容器,甲容器中加入1molN2和3 molH2,一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 molNH3,达平衡时,吸收的热量为Q2。已知Q2=4Q1,则甲容器中,H2的转化率
| A.20% | B.25% | C.75% | D.80% |
等体积,等物质的量浓度①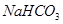 、②
、②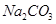 两种溶液的叙述不正确的是
两种溶液的叙述不正确的是
A.溶液中C(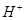 ) ②<① ) ②<① |
| B.溶液中阴离子的物质的量浓度之和:②>① |
C.②溶液中: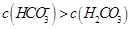 |
D.①溶液中: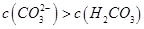 |
有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
| A.V3>V2>V1 | B.V3=V2=V1 |
| C.V3>V2=V1 | D.V1=V2>V3 |
在一定温度下,一定体积的密闭容器中有如下平衡: H2(气)+I2(气)  2HI(气)
2HI(气)
已知H2和I2的起始浓度均为0.1mol·L-1时,达平衡时HI的浓度为0.16mol·L-1。
若H2和I2的起始浓度均变为0.2mol·L-1,平衡时H2的浓度(mol·L-1)是
| A.0.16 | B.0.08 | C.0.04 | D.0.02 |