(14分)取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是________________________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)________0.1 mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)。
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=________mol/L;c(OH-)-c(HA)=________mol/L。
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“>”、“<”或“=”)。
(5)有相同温度下相同浓度的四种盐溶液:A.NH4HCO3;B.NH4A;C.(NH4)2SO4;D.NH4Cl,按pH由大到小的顺序排列________(填序号)。
(15分)纯净的过氧化钙(CaO2)是白色粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。已知:在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:
(1)“溶解”过程需要的玻璃仪器有,“沉淀”时需控制反应温度在0℃左右,比较简单易行的方法是。为检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加(填试剂),无明显现象说明“水洗”合格。
(2)“沉淀”时发生反应的离子方程式为;
该制法的副产品为(填化学式);若称取11.1克无水CaCl2,理论上应该量取质量分数30﹪、密度1.1g/cm3的H2O2溶液mL。
(3)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应;
第二步,向上述锥形瓶中加入几滴淀粉溶液;
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-→ 2I-+S4O62-(无色)】
①第三步中说明反应恰好完全的现象是
②CaO2的质量分数为(用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能
(填“偏高”、“偏低”、“无影响”、“不能确定”)。
(12分) 肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,通入肼的一极为极,该极的电极反应式是。电池工作一段时间后,电解质溶液的pH将(填“增大”、“减小”、“不变”)。
(2)肼用亚硝酸(HNO2)氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式
(3)肼和四氧化二氮作火箭推进剂,两者反应产物是氮气和水。当反应生成28.0kg还原产物时,计算参加反应的肼的质量 (写出计算过程) 。
F和G是日常生活中常用的两种合成高分子材料,可由某烃经下列反应得到: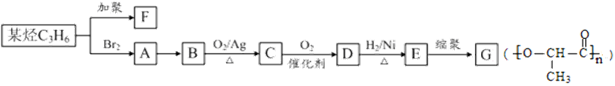
请回答下列问题:
(1)F的名称是,G中所含官能团的名称
(2)A→B的反应条件是D→E的反应类型是
(3)C的结构简式为
(4)H为C的同分异构体,且符合下列条件,其结构简式为
①能使酸性高锰酸钾溶液褪色②能与NaHCO3溶液反应放出气体
(5)E→G的化学方程式是
(12分)硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4•7H2O的流程如下:
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式开始沉淀的pH分别为:2.7,5.4,7.6;完全沉淀的pH分别为:3.7,6.5,9.7。
(1)下列能提高浸取过程中浸出效率的措施有
| A.将矿石粉碎 | B.提高浸取温度 | C.适当增加硫酸的浓度 | D.搅拌并适当延长浸取时间 |
ZnO和硫酸反应的离子方程式为
(2)加入适量锌粉后溶液中存在的金属阳离子主要有
(3)氧化过程中H2O2发生反应的化学方程式为
(4)加入适量Ca(OH)2调节溶液pH至~(填范围),促进Fe3+水解完全。Fe3+水解反应的平衡常数表达式K=
(8分)向100mL FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题: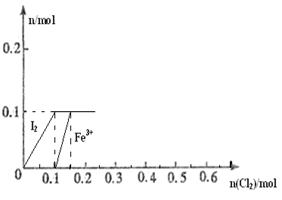
(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为___________>____________>____________。
(2)当n(Cl2)=0.12mol时,溶液中的离子主要为__________,从开始通入Cl2到n(Cl2)=0.15mol时的总反应的化学方程式为_____________________________________。
(3)当溶液中n(Cl-):n(IO3-)=8:1时,通入的Cl2在标准状况下的体积为_________