(8分)向100mL FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题: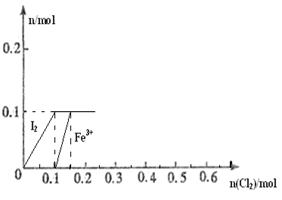
(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为___________>____________>____________。
(2)当n(Cl2)=0.12mol时,溶液中的离子主要为__________,从开始通入Cl2到n(Cl2)=0.15mol时的总反应的化学方程式为_____________________________________。
(3)当溶液中n(Cl-):n(IO3-)=8:1时,通入的Cl2在标准状况下的体积为_________
一学生设计了如下实验方法分离NaCl、CaCl2两种固体混合物: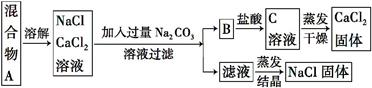
填空回答下列问题
(1)B是 (写化学式)。
(2)按此实验方案得到NaCl,经分析含有杂质,是因为上述方案中某一步设计有错误,这一步正确设计方案应是 。
(3)若要测定该样品中NaCl、CaCl2的质量比,可称量干燥的B和另一种物质的质量,这种物质是 。
(1)阅读、分析下列两个材料:
材料一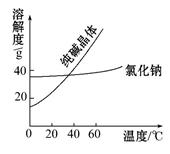
材料二
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
| 乙二醇 |
-11.5 |
198 |
1.11 |
易溶于水和乙醇 |
| 丙三醇 |
17.9 |
290 |
1.26 |
能跟水、酒精以任意比互溶 |
回答下列问题(填序号):
A.蒸馏法 B.萃取法
C.“溶解、结晶、过滤”的方法 D.分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用 ;
②将乙二醇和丙三醇相互分离的最佳方法是 。
(2)阅读材料三。
材料三 在溶解性方面,Br2(溴)与I2很相似,其稀的水溶液显黄色。在实验室里从溴水(Br2的水溶液)中提取Br2和提取I2的方法相似。
回答下列问题:
①常用的提取方法是 ,化学试剂是 ,最主要的仪器是 。
②若观察发现提取Br2以后的水还有颜色,解决该问题的方法是 。
下图所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: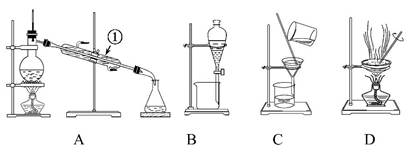
(1)从氯化钾溶液中得到氯化钾固体选择装置 (填代表装置图的字母,下同);除去自来水中的Cl-等杂质选择装置 。
(2)从碘水中分离出I2,选择装置 ,该分离方法的名称为 。
(3)装置A中①的名称是 ,进水的方向是 。装置B在分液时为使液体顺利滴下,应进行的具体操作是 。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
海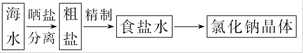
问题1:粗盐中含Ca2+、Mg2+、Fe3+、S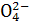 等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是 (填写序号字母)。
等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是 (填写序号字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
问题2:按所选顺序操作时,步骤④的化学方程式是
。
问题3:由海水到氯化钠晶体的实验过程中要用到的主要装置是 (从给定的四种装置中选择)。
为了除去氯化钠样品中的杂质碳酸钠,某兴趣小组最初设计了如下所示方案进行实验。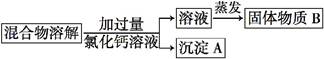
(1)沉淀A的化学式是 。
(2)加入过量氯化钙溶液后,分离除去沉淀A的实验操作是 。
(3)他们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质。固体物质B的成分
为 (用化学式表示)。
(4)他们继续探究后又提出了新的方案:将混合物溶解,滴加盐酸至不再产生气泡为止,然后加热煮沸。有关反应的化学方程式为 。
一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol·L-1的NaOH溶液(密度为1.12 g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol。
(1)原NaOH溶液的质量分数为 。
(2)所得溶液中Cl-的物质的量为 mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)= 。