在0.1 mol/L氨水中,分别加入少量下列物质,溶液中的c(OH-)增大的是
| A.加少量HNO3 | B.加少量KOH固体 |
| C.加少量(NH4)2SO4固体 | D.加大量水 |
工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。下列叙述正确的是
| A.上述反应中硫元素只被氧化 |
| B.Na2S2O3在强酸性环境中能稳定存在 |
| C.每生成1 molNa2S2O3,转移电子数为4NA |
| D.若将Na2CO3换成Na2SO3(配比不变),每吸收3 molSO2,理论上就会生成474 g Na2S2O3 |
已知:25℃时,CaCO3的Ksp为2.9×10-9,CaF2的Ksp为2.7×10-11。下列说法正确的是
| A.25℃时,在CaCO3悬浊液中加入NaF固体,CaCO3全部溶解 |
| B.25℃时,饱和CaCO3溶液与饱和CaF2溶液相比,前者Ca2+浓度大 |
| C.25℃时,CaCO3固体在盐酸中的Ksp比在氨水中的Ksp大 |
| D.25℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,不会析出CaF2固体 |
下列操作或装置能达到实验目的的是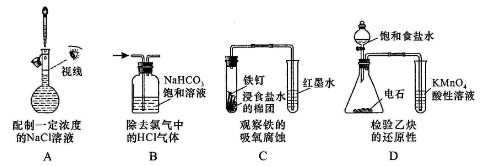
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是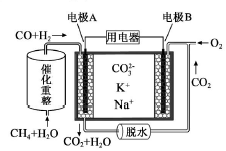
A.反应CH4+H2O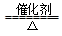 3H2+CO,每消耗1molCH4转移12mol e- 3H2+CO,每消耗1molCH4转移12mol e- |
| B.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
| C.电池工作时,CO32-向电极B移动 |
| D.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
纯净物X、Y、Z转化关系如图所示,下列判断正确的是
| A.Y不可能是氢气 |
| B.X可能是金属铜 |
| C.Z可能是氯化钠 |
| D.Z可能是三氧化硫 |