(14分)有两只密闭容器A和B,A能保持恒容,B能保持恒压。起始时向容积相等的A、B中分别通入等量的NH3气体,使之发生反应:2NH3(g) 3H2(g)+N2(g),并达到平衡。则:
3H2(g)+N2(g),并达到平衡。则:
(1)达到平衡所需要的时间:t(A) t(B),NH3的转化率:a(A) a(B) (填“>”、“=”或“<”)。
(2)反应过程中的反应速率:v(A) v(B) (填“>”、“=”或“<”)。
(3)达到平衡后,在两容器中分别通入等量的氦气。则B中的化学平衡向 反应方向移动,A中的化学反应速率 (填“增大”、“减小”或“不变”)。
(4)达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中H2的百分含量 ,B容器中NH3的百分含量 (填“增大”、“减小”或“不变”)。
某河道两旁有甲乙两厂。它们排放的工业废水中,共含K十、Ag十、Fe3+、C1-、OH-、NO3--六种离子。甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子_______、_______、_______。
乙厂的废水中含有另外三种离子。如果加一定量_______(选填:活性炭、硫酸亚铁、铁粉)。可以回收其中的金属_______(填写金属元素符号)。
另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的_______(填写离子符号)转化为沉淀。经过滤后的废水主要含_______,可用来浇灌农田。
(1)在250C、101KPa时,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ,则能表示甲醇燃烧的热化学方程式为:
________________________________________________________________________。
(2)已知:C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)="==" CO2(g);△H=—394kJ·mol—1;
2CO(g)+O2(g)="==" 2CO2(g);△H=—566kJ·mol—1;
2H2(g)+O2(g)="==" 2H2O(g);△H=—484 kJ·mol—1;
①在25℃、101KPa时,1 g甲醇不完全燃烧生成1∶1的CO、CO2和液态水,写出此甲醇燃烧的热化学方程式:
_____________________________________________________________________。
②工业上可由CO和H2合成甲醇。试写出由C(s)与水蒸气在高温条件下反应生成氢气
和一氧化碳的热化学方程式。
(3)利用甲醇可设计燃料电池。
①如用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入甲醇和氧
气。写出负极的电极反应式。
②下列有关甲醇燃料电池的说法中,错误的是_________
A.甲醇燃料电池的负极发生氧化反应
B.甲醇燃料电池的电子由负极、经外电路流入正极
C.甲醇燃料电池在负极区产生CO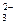
D.甲醇燃 料电池中使用的氢氧化钾浓度保持不变
料电池中使用的氢氧化钾浓度保持不变
W、X、Y、Z是短周期主族元素,它们的核电荷数依次增大。下表列出它们的性质和原子结构:
| 元素编号 |
元 素性质或原子结构 素性质或原子结构 |
| W |
原子电子层数与核外电子数相等 |
| X |
核外s能级上的电子总数与p能级上的电子总数相 等 等 |
| Y |
元素的原子半径在该周期中最大(除稀有气体外) |
| Z |
原子核外p能级上的电子总数比s能级上的电子总数多2 |
(1)元素符号:X_______________,Z________________。
(2)Y元素原子的核外电子排布式为__________________。
(3)X元素原子的核外有种不同形状的电子云。
(4)Y元素的单质在W和X形成的化合物中反应的离子方程式为
___________________________________________________________________ 。
在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=__________________________。
已知:K(300℃)>K(350℃),该反应是__________热反应(填“放”或“吸”)。
(2)上述反应达平衡时,NO的转化率=__________________。
(3)下图中表示NO2的变化的曲线是____________(选填字母,下同)。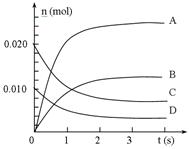
(4)能说明该反应已经达到平衡状态的是___________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.NO和NO2两物质的浓度相等
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效的催化剂
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.CO2与化合物A反应生成化合物B,如下反应式(其它试剂、产物及反应条件均省 略)。
略)。
(1)化合物B的分子式为__________,1 mol该物质完全燃烧需消耗_________mol O2。
(2)由 通过消去反应制备A的化学方程式为(注明反应条件):
通过消去反应制备A的化学方程式为(注明反应条件):
_______________________________________________________________________。
(3)B与过量C2H5OH在酸催化下发生酯化反应,生成的有机物的结构简式为:
__________________________________________。
(4)与CO2类似,CO也能被固定和利用。在一定条件下,CO、 和
和
H2三者发生反应(苯 环不参与反应),生成化合物C的分子式为C9H8O,且物质C能发生银镜反应。写出生成物C可能的结构简式:
环不参与反应),生成化合物C的分子式为C9H8O,且物质C能发生银镜反应。写出生成物C可能的结构简式:
___________________________________________________________________。