自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:
SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g) ΔH =" —148.9" kJ/mol
SiF4(g)+ 2H2O(g) ΔH =" —148.9" kJ/mol
根据题意完成下列填空:
(1)在地壳深处容易有 气体逸出,在地壳浅处容易有 沉积。
(2)如果上述反应的平衡常数K值变大,该反应 (选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号)。
a.2v正(HF)=v逆(H2O) b.v正(H2O)=2v逆(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为 。
肉桂酸甲酯是治疗白癜风的重要药物,也是一种用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,其结构和性质如表所示:
| 结构 |
分子中只含有一个苯环,苯环上只有一个取代基且无支链,核磁共振氢谱图中有六个吸收峰,峰面积比为1∶2∶2∶1∶1∶3 |
| 性质 |
①能使溴水因发生化学反应而褪色②在NaOH溶液中易发生水解反应生成具有剧毒的醇类物质 |
试回答下列问题:
(1)肉桂酸甲酯的结构简式为________。
(2)用芳香烃A为原料合成肉桂酸甲酯G的路线如下: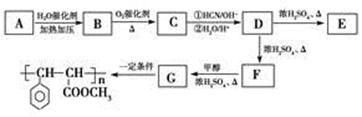
已知:i.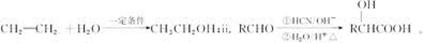
①B的结构简式为________,C中含有的官能团名称为________。
②D→F的反应类型是________;F→G的反应类型是________。
③D转化为F的化学方程式是______________________;
④E为含有三个六元环的酯,其结构简式是_____________________________。
⑤D分子中具有多种官能团,不能发生的反应类型有(填序号)________。
a.酯化反应
b.取代反应
c.加聚反应
d.水解反应
e.消去反应
f.氧化反应
⑥写出符合下列条件的D的同分异构体的结构简式______________________。
i.分子内含苯环,且苯环上只有一个支链;
ii.在催化剂作用下,1 mol该物质与足量氢气充分反应,最多消耗4 mol H2;
iii.它不能发生水解反应。
邻羟基桂皮酸是合成香精的重要原料,下为合成邻羟基桂皮酸的路线之一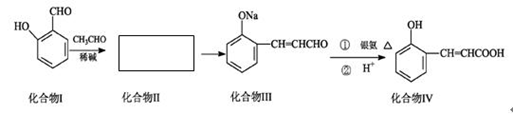
已知: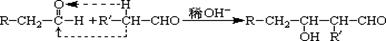
试回答下列问题:
(1)化合物II的结构简式为:
(2)化合物II→化合物III的有机反应类型
(3)化合物III在银氨溶液中发生反应化学方程式
(4)有机物X为化合物IV的同分异构体,且知有机物X有如下特点:①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。请写出化合物X的结构简式
(5)下列说法正确的是
| A.化合物I遇氯化铁溶液呈紫色 |
| B.化合物II能与NaHCO3溶液反应 |
| C.1mol化合物IV完全燃烧消耗9.5molO2 |
| D.1mol化合物III能与3 mol H2反应 |
(6)有机物R(C9H9ClO3)经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为 。
(2014)叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成。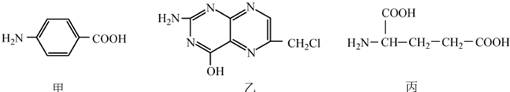
(1)甲中显酸性的官能团是 (填名称)。
(2)下列关于乙的说法正确的是 (填序号)。
a.分子中碳原子与氮原子的个数比是7:5
b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应
d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,丁的结构简式为 。
a.含有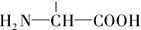 b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成
(4)甲可以通过下列路线合成(分离方法和其他产物已经略去):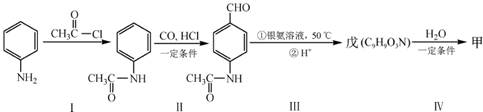
①步骤I的反应类型是 。
②步骤I和Ⅳ在合成甲过程中的目的是 。
③步骤Ⅳ反应的化学方程式为 。
已知有机物A和B都只含C、H、O三种元素。
(1)A的相对分子质量为62,A经催化氧化生成D,D经催化氧化生成E,A与E在一定条件下反应可生成一种环状化合物F。
则A的分子式为________,结构简式为________;A与E反应生成F的反应类型为________。
(2)对有机物B的组成、结构进行分析测定,得实验结果如下:
①完全燃烧166 mg有机物B,得到352 mg CO2和54 mg H2O;
②测出B的核磁共振氢谱有2个峰,红外光谱显示结构中含苯环和羧基;
③B的相对分子质量在100~200之间。
则B的相对分子质量为________,结构简式为________。
(3)A与B在一定条件下反应可生成一种常见合成纤维,该反应的化学方程式为________________。
乙酸苯甲酯(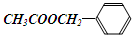 )是有香味的有机化合物,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是有香味的有机化合物,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
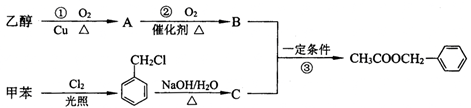
(1)C的名称为 。
(2)写出反应①的化学方程式: 。
(3)反应③的反应类型为 。
(4)反应 (填序号)原子的理论利用率为100%,符合绿色化学的要求。