人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)铁元素位于元素周期表的 区;其基态原子的电子排布式为 。
(2)铜原子的价电子排布式为 ,画出配离子[Cu(H2O)4]2+中的配位键____ _______。
(3)二氧化碳分子的立体构形为 形,其中C原子的杂化方式为 杂化,二氧化碳分子中含有 个σ键和 个π键。
(4)氨分子属于 分子(填“极性”或“非极性”);氨极易溶于水最主要的原因是氨分子和水分子之间可以形成 。
(5)下列元素的第一电离能最大的是( )
A.Be B.C C. N D.O
(6)下列分子中,所有原子都满足最外层为8电子结构的是 ( )
A.XeF2 B.BeCl2 C.PCl3 D.CHCl3
(7)下列晶体中,熔点最高的是 。
A.金刚石 B.干冰 C.铝 D.氯化钠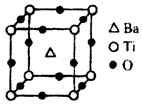
(8)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如上图,它的化学式是 。
(1)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 。
(2)CuO中混有少量Al2O3,除杂试剂()离子方程式;
(3)FeCl2溶液中混有少量FeCl3,除杂试剂()离子方程式 。
写出下列各离子反应方程式
(1)氢氧化铝和盐酸的反应
(2)钠和盐酸的反应
(3)钠和硫酸铜的反应
氧化还原反应在工农业生产和日常生活中有广泛运用。(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应为:C6H12O6+6O2 = 6CO2+6H2O+能量,该反应中的还原剂是。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有。(填“氧化性”或“还原性”);
(3)Fe3+在工业上有重要用途。例如印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,写出离子方程式。
(4)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是。如果药片已经失效,应如何检验?写出主要操作与现象:
实验室要用98%(ρ=1.84g·cm-3)的硫酸配制3.68mol·L-1的硫酸溶液500mL
(1)需准确量取98%的硫酸 mL。
(2)准确量取一定体积的98%的硫酸后,要配制3.68mol·L-1的硫酸溶液500mL,必须用到的实验仪器是(填写序号):.
①500mL量筒②烧杯③1000mL容量瓶④500mL容量瓶
⑤天平⑥胶头滴管⑦锥形瓶⑧玻璃棒
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将例所配制的硫酸溶液浓度的影响(偏高,偏低,或不变)
| A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 |
| B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。 |
| C.用胶头滴管向容量瓶中加水时溶液凹液面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切。 |
| D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度相切。 |
某温度时,在2 L 密闭容器中,X、Y、Z三种物质 的物质的量随时间变化的曲线如下图所示,由图中数据分析:
1)该反应的化学方程式为:;
(2)反应开始至2 min末,X的反应速率为_____________________________;
(3)该反应是由开始反应的(填“正反应”、“逆反应”或“正、逆反应同时”)