(12分)⑴铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中却生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是___________,其中氧化性最强的是_______。
⑵盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下三个反应,请指出盐酸在三个反应中所分别表现的性质:
①Zn+2HCl=ZnCl2+H2↑ ______________________________
②Fe2O3+6HCl=2FeCl3+2H2O ______________________________
③2HCl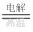 H2↑+Cl2↑ ______________________________
H2↑+Cl2↑ ______________________________
⑶找出⑵小题中属于氧化还原反应的化学方程式并标出电子转移的方向和数目。
(16分)化学学习中要注重对过程的分析,按要求回答下列问题:
(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液到中性,写出发生反应的离子方程式____;在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式________。
(2)将一小块钠投入到盛氯化铵的溶液中,有氨气生成,其反应过程分为两步,其中第二步反应的离子方程式为__________。
(3)过氧化钠与干燥的二氧化碳不反应,与湿润的二氧化碳反应生成氧气,则该过程的两个反应方程式分别为___________________、__________________。
(4)向石蕊试剂中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是__________、_________。
(5)向含1molFeBr2的溶液中通入______L(标准状况下)氯气,才能将Fe2+全部转化为Fe3+。(6)足量的铜与一定体积的浓硫酸反应,反应后溶液中所含的溶质有______(填化学式)。
(15分) 硼和铝位于同一主族,它们可以形成许多组成和性质类似的化合物,一种用硼镁矿(Mg2B2O5·H2O)制取单质硼的工艺流程图如下: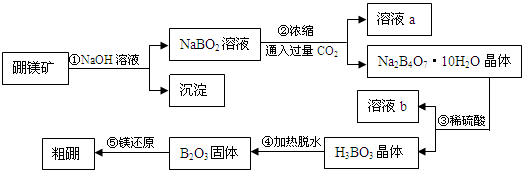
回答下列问题:
(1)Mg2B2O5·H2O中B的化合价为_____________。
(2)溶液a、溶液b中溶质的化学式分别为_________、_________。
(3)写出步骤①的化学方程式_______________________________。
(4)写出步骤⑤的化学方程式_______________________________。
(5)步骤③中化学反应可以发生的原因是______________________。
(6)BF3是有机化学中常用的酸性催化剂,BF3分子中B和F最外层的电子数分别为_____、______个。
(7)乙硼烷(B2H6)是一种气态高能燃料,写出乙硼烷在空气中燃烧的化学方程式____。
(18分)通过对模型、图形、图表的观察,获取有关信息是化学学习的一种重要能力。
(1)如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。按要求回答问题: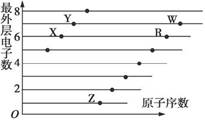
①Y元素在元素周期表中的位置为__________。
②气态氢化物的稳定性:X_____(填“>”“<”)Y。
③这五种元素形成的简单离子中,离子半径最大的是_______(填离子符号)。
④Z的氢化物ZH可以和水发生氧化还原反应,其反应方程式为_____________。
(2)X、Y、Z三种物质有以下转化关系: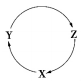
①如果三种物质中均含Mg元素,且X为镁单质,则Y、Z可能是_____、_______(填化学式,只填一种物质即可,下同);
②如果三种物质中均含Cl元素,且X为Cl2,则Y、Z可能是_____、______;
③如果三种物质中均含Si元素,且X为SiO2,则Y、Z可能是_____、______。
(3)向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,生成沉淀质量m与Ba(OH)2体积V之间的关系,则oa段生成的沉淀为____(填化学式,下同),ab段生成的沉淀为_____;bc段生成的沉淀为_________。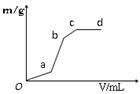
(15分)要准确掌握化学基本概念和研究方法。按要求回答下列问题:
(1)下列是某同学对有关物质进行分类的列表:
每组分类均有错误,其错误的物质分别是_______(填化学式,下同)、_______、______。
(2)胶体和溶液的本质区别是______;鉴别胶体和溶液所采用的方法是观察是否能发生__________现象。
(3)下列3个反应,按要求填写相关量。
①2Na2O2 + 2H2O == 4NaOH + O2↑反应中,每消耗1mol Na2O2生成_______g O2;
②2NaHCO3=Na2CO3+H2O+CO2↑反应中,每消耗168g NaHCO3,标况下生成___L CO2;
③Cl2+H2O=HCl+HClO反应中,标况下每消耗22.4L Cl2,转移_____mol电子。
(4)在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,按要求回答下列问题: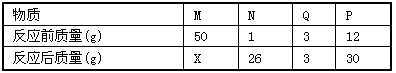
①该变化的基本反应类型是________反应; ②物质Q在反应中起的作用是_______。
(8分)标准状况下,进行甲、乙、丙三组实验,各取30.0 mL相同浓度的盐酸,然后分别慢慢地加入不同质量的同一种镁铝合金粉末,得下列有关数据(假设反应前后溶液的体积不发生变化):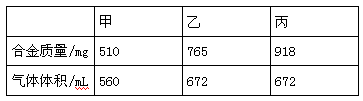
根据实验数据,计算:
(1)盐酸中HCl的物质的量浓度为_____________。
(2)合金中镁的质量分数(计算结果保留至0.1%,有必要的计算步骤和语言叙述,只写答案不得分,下同)。
(3)甲组实验后,还需向容器中加入lmol·L-1的NaOH溶液多少毫升恰好使铝元素以[Al(OH)4]-存在,并使Mg2+刚好沉淀完全?