(12分)Ti有“太空金属”之称,在常温下,其单质比较稳定,不与非金属、强酸反应;在高温下,Ti可与常见非金属反应。以钛铁矿(FeTiO3)为主要原料冶炼金属钛的一种工业生产流程如下: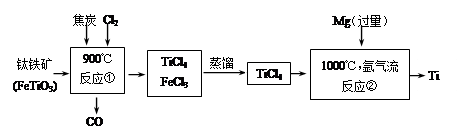
⑴反应①中焦炭作 剂(选填“氧化”、“还原”,下同),Cl2作 剂。
⑵反应②的化学方程式为 ,该反应的基本类型是 ;反应②须在氩气流中进行的原因是 。
⑶从反应所得金属钛中含有金属镁,从混合物中获取钛的方法是
。
松油醇是一种调味香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(结构式和H2O中的“18”是为区分2个羟基而人为加上去的)经如图所示反应制得.
试回答:
(1)α松油醇的分子式是________.
(2)α松油醇所属的物质类别是________.
a.醇 b.酚 c.饱和一元醇
(3)α松油醇所能发生的反应类型是________.
a.加成 b.水解 c.氧化
(4)写出结构简式:β松油醇:___________________________________________;
γ松油醇:________________________.
从樟科植物枝叶提取的精油中含有下列甲、乙两种成分:
(1)甲中含氧官能团的名称为________.
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物):
其中反应Ⅰ的反应类型为________,反应Ⅱ的化学方程式为____________________(注明反应条件).
某实验小组用下列装置进行乙醇催化氧化的实验.
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:
________________________________________________________________________
________________________________________________________________________.
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇的氧化反应是________反应.
(2)甲和乙两个水浴作用不相同.
甲的作用是________;乙的作用是________.
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________.集气瓶中收集到的气体的主要成分是________.
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有________.要除去该物质,可先在混合液中加入________(填写字母).
a.氯化钠溶液 b.苯
c.碳酸氢钠溶液 d.四氯化碳
然后,再通过________(填实验操作名称)即可除去.
由丁炔二醇可以制备l,3丁二烯.请根据下面的合成路线图填空:
(1)写出各反应的反应条件及试剂名称:
X____________;Y______________;Z____________.
(2)写出A、B的结构简式:
A________________;B________________.
已知戊醇(C5H12O)共有8种属于醇的同分异构体,请回答:
(1)戊醇的这8种同分异构体中能氧化成醛的有4种,它们是:CH3(CH2)3CH2OH和(写结构简式)____________________________________________________________________
________________________________________________________________________.
(2)戊醇的这8种同分异构体脱水后可得________种烯烃.