硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ. SO2+2H2O+I2===H2SO4+2HI
Ⅱ. 2HI H2+I2
H2+I2
Ⅲ. 2H2SO4===2SO2+O2+2H2O
(1) 分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2) 一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
① 0~2 min内的平均反应速率v(HI)= 。
② 该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= 。
2HI(g)的平衡常数K= 。
③ 相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3) 实验室用Zn和稀硫酸制取H2,反应时若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
将羧酸的碱金属盐电解可得到烃类化合物。例如: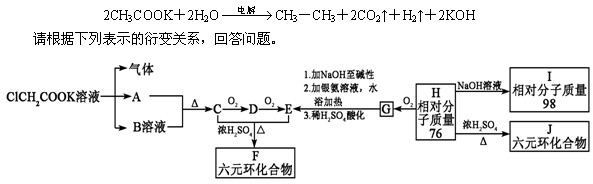
(1)写出下列物质的结构简式A: E:
(2)G能发生反应的类型有(填序号):
a.取代 b.加成 c.还原 d.氧化 e.消去 f.水解
(3)写出H的最简单的两种同系物的结构简式,。
(4)F与J的关系为
a.同一物质 b.同系物 c.同分异构体 d.同素异形体
烯烃中碳碳双键是重要的官能团,在不同条件下能发生多种变化。
(1)烯烃的复分解反应就是两种烯烃交换双键两端的基团,生成两种新烯烃的反应。请写出在催化剂作用下,两个丙烯分子间发生复分解反应的化学方程式。
(2)烯烃与酸性高锰酸钾溶液反应的氧化产物有如下的对应关系: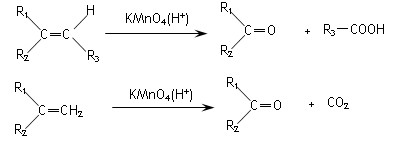
已知某烯烃的化学式为C5 H10 ,它与酸性高锰酸钾溶液反应后得到的产物若为乙酸和丙酸,则此烯烃的结构简式是;若为二氧化碳和丁酮( ),则此烯烃的结构简式是。
短周期元素A、B、C、D中,0.5molA元素的离子得到的6.02×1023个电子后被还原为中性原子;0.4克A的氧化物恰好与100mL 0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等。B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)推断A、B、C、D四种元素的符号A;B;C;D;
(2)C-离子的原子结构示意图;
(3)D元素的最高价氧化物的结构式是:;
(4)C、D元素组成的物质,分子内含有键(填“极性”或“非极性”,下同),其分子为分子。
已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的相对分子质量比D的相对分子质量大16,在一定条件下,各物质相互转化关系如下图所示。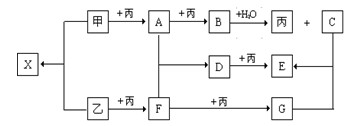
请按要求填空:
(1)丙的化学式是,G的化学式是。
(2)写出有关变化的化学方程式
甲 + 乙:;
D + 丙:。
(3)B与X的水溶液反应生成C和乙的离子方程式是。
(共18分)有机物A、B、C、D、E、F有如下转化关系,化合物A的水溶液呈弱酸性,其苯环上的一氯代物只有2种,其分子中含碳、氢两元素的质量分数和为85.19%,相对分子质量小于110,E为一种最简单的芳香酸。
请回答下列问题:
(1)写出C转化成D的反应条件。
(2)B的结构简式,F的分子式。
(3)与C具有相同环的同分异构体共有(含C)种,请写出其中的任意3种与C不同类别有机物的结构简式。
(4)写出反应②的化学方程式。
写出反应④的化学方程式。