甲、乙、丙三位同学各设计了一个实验,结果各自都认为自己的试样中含有SO42-离子。
甲的实验为:
(1)乙认为甲的实验不严谨,因为试样A中若含有 离子(仅填一种)也会有此现象。
乙的实验为:
(2)丙认为乙的实验也不严谨,因为试样B中若含有 离子(仅填一种)也会有此现象。
丙的实验为:
若丙方案合理,回答:
(3)若丙实验合理,则其中试剂Ⅰ是 ,现象Ⅰ是 ;试剂Ⅱ是 ,现象Ⅱ是 。(若你认为丙方案不合理,以上四空可以不填)
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:
提示:在本实验条件下,Ni(Ⅱ)不能被氧化:高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②发生反应的离子方程式为 、
(2)反应④中产物的成分可能是ZnCO3·xZn(OH)2 .取干操后的滤饼11.2g,煅烧后可得到产品8.1 g. 则x等于_____________。
(3)K2FeO4-Zn可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________________,该电池总反应的离子方程式为____________________________。
某学习小组探究溴乙烷的消去反应并验证产物。
实验原理:CH3CH2Br + NaOH CH2=CH2↑ + NaBr + H2O
CH2=CH2↑ + NaBr + H2O
实验过程:组装如图1所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因:。
(2)丙同学认为只要对实验装置进行适当改进,即可避免对乙烯气体检验的干扰,改进方法。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是,此时发生反应的化学方程式为(只写主要发生的反应):。
(4)结合资料二、三,你认为还应该在实验装置中增加的两种仪器是
①。
②。
I.(1)某同学做如下实验,以检验反应中的能量变化。
实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是__________热反应;(b)中温度降低, 根据能量守恒定律,(b)中反应物的总能量应该__________其生成物的总能量。
(2)下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银。其中(用序号填空):能设计成原电池的反应是_________。
II.(1)有下列几种物质
A.金刚石和石墨
B.C2H6和C5H12
C.C2H4和C2H6
D.CH3CH2CH2CH3和CH3CH(CH3)2
E.35Cl和37Cl
属于同分异构体的是_____;属于同素异形体的是_____;属于同系物的是_____;属于同位素的是______。
(2)两种粒子的核外电子排布相同,核电荷数不同,则它们可能是( )
A.两种不同元素的原子 B.一定是两种不同的离子
C.同一元素的原子和离子 D.两种不同元素的原子和离子
III.(1)C7H16名称
(2)指出下列反应的类型:乙烯使酸性高锰酸钾溶液褪色:
(3)写出反应的化学方程式:三氯甲烷与氯气在光照下反应
(14分)某学生欲配制6.0 mol·L-1的H2SO4 1 000 mL,实验室有三种不同浓度的硫酸:①480 mL 0.5 mol·L-1的硫酸;②150 mL 25%的硫酸(ρ=1.18 g·mL-1);③足量的18 mol·L-1的硫酸。有三种规格的容量瓶:250 mL、500 mL、1 000 mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为______ mol·L-1(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为______ mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18 mol·L-1的浓硫酸____ mL,沿玻璃棒倒入上述混合液中,并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D.用适量的水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶中;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1 cm~2 cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?______(填“偏大”“偏小”或“无影响”)。
(5)进行操作C前还需注意__________________________________。
如图所示的实验装置可用来测定含两种元素的某种气体X的分子式。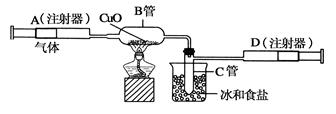
在注射器A中装有240毫升气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32克,实验后B管重20.00克,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。试回答下列问题:
(1)X气体是由________和________元素组成的。
(2)若240毫升X气体完全反应后,收集到的氮气质量是0.28克。根据实验时温度和压强计算1摩尔X气体的体积是24000毫升,则X的摩尔质量是________克/摩尔。
(3)通过计算,确定X的分子式为________。
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应)__________________。